
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
Ранее рассматривались процессы, у которых имелись четко определенные постоянные признаки: изохорный процесс осуществлялся при постоянном объеме, изобарный – при постоянном давлении, изотермический – при постоянной температуре, адиабатный – при отсутствии теплообмена между веществом и внешней средой. Ясно, что наряду с этими процессами можно представить множество процессов, у которых имеются другие постоянные признаки.
Известно, что
реальные процессы сжатия в газовых
двигателях, компрессорах и т. д., как
правило, не являются ни изотермическими,
ни адиабатными, а занимают некоторое
промежуточное положение в том смысле,
что уравнение этих реальных процессов
 имеет показатель степени отличный от
имеет показатель степени отличный от
 и от
и от
 .
Это так называемые политропные процессы.
.
Это так называемые политропные процессы.
Всякий процесс, в котором теплоемкость является постоянной величиной, называют политропным.
Найдем уравнение политропы для идеального газа. Для этого в первый закон термодинамики

вместо элементарного
количества тепла
подставим
 ,
вместо изменения внутренней энергии –
,
вместо изменения внутренней энергии –
 и вместо элементарной работы
и вместо элементарной работы
 В результате получим:
В результате получим:
 . (2.7.36)
. (2.7.36)
Из уравнения
Менделеева – Клапейрона
найдем

 . (2.7.37)
. (2.7.37)
Подставим (2.7.37) в (2.7.36). В результате будем иметь:
 (2.7.38)
(2.7.38)
Учитывая, что для
идеального газа
 ,
получим:
,
получим:
 . (2.7.39)
. (2.7.39)
Разделим обе части
последнего равенства на
 В результате оно примет вид:
В результате оно примет вид:
 (2.7.40)
(2.7.40)
Введя обозначение
 (2.7.41)
(2.7.41)
проинтегрируем обе части выражения (2.7.40). В результате интегрирования получаем:

Упрощая последнее соотношение, окончательно запишем:
 (2.7.42)
(2.7.42)
Это и есть искомое уравнение политропного процесса. Используя уравнение Менделеева – Клапейрона, легко получить уравнение политропы в других переменных:
 (2.7.43)
(2.7.43)
 (2.7.44)
(2.7.44)
Из формулы (2.7.41)
нетрудно найти выражение для теплоемкости
 политропного процесса через показатель
политропы
политропного процесса через показатель
политропы

 (2.7.45)
(2.7.45)
Уравнение (2.7.45)
позволяет определить теплоемкость
политропного процесса если известен
показатель политропы
 Последний определяется из экспериментальных
данных. Пусть в начальном состоянии
давление и объем газа были равны
соответственно
Последний определяется из экспериментальных
данных. Пусть в начальном состоянии
давление и объем газа были равны
соответственно
 в конечном –
в конечном –
 Тогда из уравнения политропы (2.7.42)
находим
Тогда из уравнения политропы (2.7.42)
находим
 (2.7.46)
(2.7.46)
Подставив в (2.7.46) найденные из опыта величины, определим для данного реального процесса величину
Покажем, что из уравнений политропного процесса как частный случай следуют четыре ранее рассмотренных процесса.
1. В изохорном
процессе теплоемкость
 .
Тогда знаменатель в (2.7.41) обращается в
нуль, а числитель не равен нулю, так как
.
Поэтому показатель политропы
.
Тогда знаменатель в (2.7.41) обращается в
нуль, а числитель не равен нулю, так как
.
Поэтому показатель политропы
 Причем
Причем
 если теплоемкость
при стремлении к
все время остается меньше
,
в этом случае
если теплоемкость
при стремлении к
все время остается меньше
,
в этом случае
 ,
,
 и, как видно из (2.7.41),
и, как видно из (2.7.41),
 Величина
Величина
 если теплоемкость
при стремлении к
все время остается больше
,
тогда
если теплоемкость
при стремлении к
все время остается больше
,
тогда
 ,
но в пределе
,
но в пределе
 и, таким образом,
и, таким образом,
 При этом из уравнения политропы (2.7.44)
получим:
При этом из уравнения политропы (2.7.44)
получим:

Откуда следует
уравнение изохоры
 .
.
2. В изобарном
процессе теплоемкость
 и
и
 ,
т. к.
,
т. к.
 .
Тогда из уравнения политропы (2.7.43) имеем:
.
Тогда из уравнения политропы (2.7.43) имеем:
 .
.
Отсюда следует
уравнение изобары

3. В изотермическом
процессе теплоемкость
 Тогда для показателя политропы получаем:
Тогда для показателя политропы получаем:

Подставляя это
значение
 в уравнение политропы (2.7.42), получим
уравнение изотермы
.
в уравнение политропы (2.7.42), получим
уравнение изотермы
.
4. Наконец, в
адиабатном процессе
 и
.
В этом случае из уравнения политропы
(2.7.42) следует уравнение адиабаты
и
.
В этом случае из уравнения политропы
(2.7.42) следует уравнение адиабаты
 .
.
Используя результаты этих четырех случаев, а также формулу (2.7.45), можно построить график зависимости теплоемкости C политропного процесса от показателя политропы .
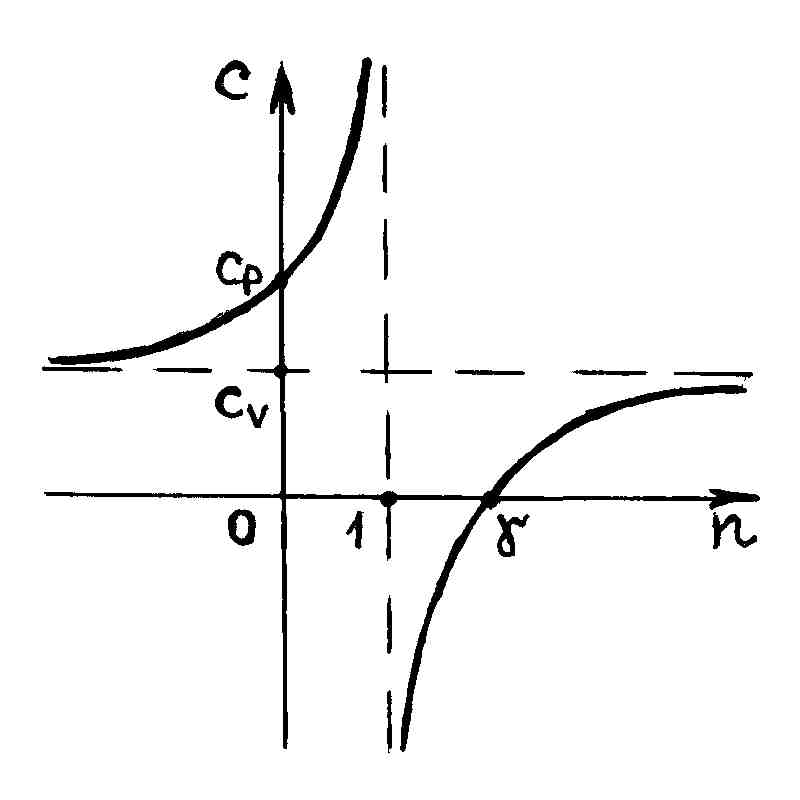
Р и с. 30
Из рис. 30 видно,
что теплоемкость
 ,
если показатель политропы принимает
значение на интервалах
,
если показатель политропы принимает
значение на интервалах
 и
и
 Этот результат следует из (2.7.45). В самом
деле, если
Этот результат следует из (2.7.45). В самом
деле, если
 ,
то
,
то
 ,
т. к. всегда
,
т. к. всегда
 и, таким образом,
;
если же
и, таким образом,
;
если же
 ,
то
,
то
 ,
т. к.
и снова
,
т. к.
и снова

И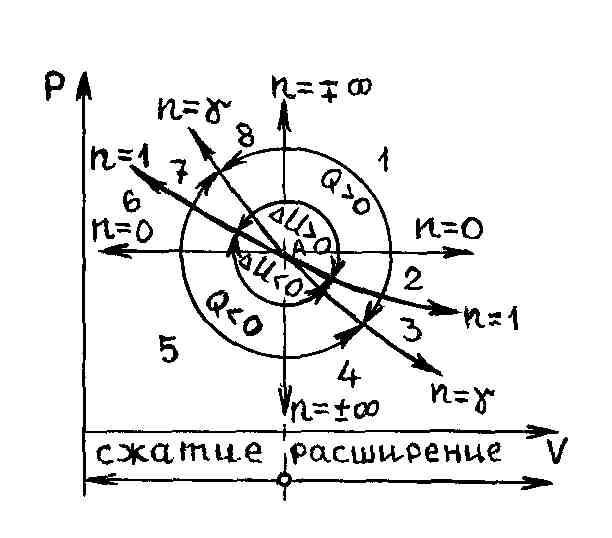 з
рис. 30 также видно, что политропный
процесс, характеризуемый показателем
з
рис. 30 также видно, что политропный
процесс, характеризуемый показателем
 ,
имеет отрицательную теплоемкость. Это
тоже следует из формулы (2.7.45). Действительно,
в этом случае
,
,
имеет отрицательную теплоемкость. Это
тоже следует из формулы (2.7.45). Действительно,
в этом случае
,
 и теплоемкость
и теплоемкость

Р и с. 31.
Интересно посмотреть
расположение и характер уравнения
политропы в переменных
 .
На рис. 31 в качестве начального состояния
газа взята точка А,
через которую проведены кривые,
соответствующие изохорному, изобарному,
изотермическому и адиабатному процессам
как в сторону расширения газа, так и в
сторону его сжатия. Вся плоскость
,
таким образом, разбилась на восемь
областей с определенными свойствами.
Линии процессов, начинающиеся в точке
А и
расположенные в областях 1–4, соответствуют
расширению газа и он, таким образом,
производит работу против внешних сил
.
На рис. 31 в качестве начального состояния
газа взята точка А,
через которую проведены кривые,
соответствующие изохорному, изобарному,
изотермическому и адиабатному процессам
как в сторону расширения газа, так и в
сторону его сжатия. Вся плоскость
,
таким образом, разбилась на восемь
областей с определенными свойствами.
Линии процессов, начинающиеся в точке
А и
расположенные в областях 1–4, соответствуют
расширению газа и он, таким образом,
производит работу против внешних сил
 ,
а в областях 5–8 происходит сжатие газа
и над ним совершается работа
,
а в областях 5–8 происходит сжатие газа
и над ним совершается работа
 .
Процессы, начинающиеся в точке A
и лежащие в
областях 4–7, совершаются с отводом
теплоты, а в областях 1–3 и 8 – с подводом
теплоты. Изотерма, вдоль которой
внутренняя энергия идеального газа не
изменяется
.
Процессы, начинающиеся в точке A
и лежащие в
областях 4–7, совершаются с отводом
теплоты, а в областях 1–3 и 8 – с подводом
теплоты. Изотерма, вдоль которой
внутренняя энергия идеального газа не
изменяется
 делит всю плоскость
на две области, в одной из которых
(области 1,2,7,8) внутренняя энергия газа
возрастает (увеличивается температура),
в другой (3–6) – убывает (уменьшается
температура газа). Политропные процессы,
протекающие в областях 3 и 6, имеют
отрицательную теплоемкость. В пределах
области 3 процессы происходят с подводом
теплоты и с уменьшением температуры
газа, а в области 6 совершаются с
увеличением температуры газа и отводом
теплоты.
делит всю плоскость
на две области, в одной из которых
(области 1,2,7,8) внутренняя энергия газа
возрастает (увеличивается температура),
в другой (3–6) – убывает (уменьшается
температура газа). Политропные процессы,
протекающие в областях 3 и 6, имеют
отрицательную теплоемкость. В пределах
области 3 процессы происходят с подводом
теплоты и с уменьшением температуры
газа, а в области 6 совершаются с
увеличением температуры газа и отводом
теплоты.
Если теплоемкость политропного процесса известна, то элементарное
количество теплоты полученное (отданное) идеальным газом в этом процессе, находится по формуле (2.5.4):
(2.7.47)
Подставляя в
последнее соотношение выражение
теплоемкости из (2.7.45) и интегрируя его
с учетом того, что для политропного
процесса
 ,
получим формулу для количества тепла:
,
получим формулу для количества тепла:
 . (2.7.48)
. (2.7.48)
Отметим, что теплота, полученная идеальным газом при политропном процессе, в общем случае расходуется на изменение внутренней энергии и на совершение внешней работы.
Так как внутренняя энергия является функцией состояния, то ее изменение для любого процесса идеального газа
 (2.7.49)
(2.7.49)
Составим соотношение из выражений (2.7.48–2.7.49)
 . (2.7.50)
. (2.7.50)
Коэффициент
 показывает, какая часть тепла, полученная
при поли-тропном процессе, идет на
увеличение внутренней энергии и
опреде-ляется через показатели политропы
и адиабаты. К примеру, для изохорного
процесса
показывает, какая часть тепла, полученная
при поли-тропном процессе, идет на
увеличение внутренней энергии и
опреде-ляется через показатели политропы
и адиабаты. К примеру, для изохорного
процесса
 ,
т. е. все подведенное к газу тепло при
изохорном процессе идет на увеличение
его внутренней энергии.
,
т. е. все подведенное к газу тепло при
изохорном процессе идет на увеличение
его внутренней энергии.
Аналогично вводится коэффициент
 (2.7.51)
(2.7.51)
который показывает,
какая часть тепла, полученная при
политропном процессе, идет на совершение
работы против внешних сил. Так, например,
для изохорического процесса

 ,
т. е. внешняя работа в этом процессе не
совершается. Легко видеть, что
,
т. е. внешняя работа в этом процессе не
совершается. Легко видеть, что

Найдем работу,
совершаемую в политропном процессе. Из
уравнения политропы
 определим давление
и подставим его в (2.4.5):
определим давление
и подставим его в (2.4.5):
 (2.7.52)
(2.7.52)
Выполняя интегрирование, получим:
 (2.7.53)
(2.7.53)
где
 – соответственно давление, объем и
температура газа в начальном состоянии,
– объем в конечном состоянии.
– соответственно давление, объем и
температура газа в начальном состоянии,
– объем в конечном состоянии.
Из уравнения
политропы
 найдем
найдем
 и подставим в (2.7.53). В результате будем
иметь еще одно выражение для работы
в политропном процессе:
и подставим в (2.7.53). В результате будем
иметь еще одно выражение для работы
в политропном процессе:
 (2.7.54)
(2.7.54)
