
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
Большинство химических веществ состоит из многоатомных молекул. Если рассматривать газообразное состояние вещества, то при столкновениях молекул тепловая энергия газа случайным образом расходуется на изменение кинетических энергий поступательного и вращательного движений молекул, а также на возбуждение колебаний атомов в молекуле. Естественно предположить, что указанные движения в молекуле могут происходить одновременно.
Чтобы найти среднюю энергию молекулы, приходящуюся на все виды ее движения, сначала выясняют, каким числом степеней свободы обладает данная молекула, и далее, – какая энергия приходится в среднем на одну степень свободы.
Число степеней свободы i молекулы равно количеству независимых координат, определяющих ее положение относительно выбранной системы координат.
Если рассматривать
атомы как бесструктурные точки, то
одноатомные молекулы могут иметь
только энергию поступательного движения.
Число степеней свободы каждой такой
точки iпост
= 3 (три
декартовы координаты x,
y,
z
или три сферические
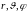 определяют положение одноатомной
молекулы в пространстве). Система,
состоящая из N
одноатомных
молекул, между которыми нет жестких
связей, имеет 3N
степеней свободы.
определяют положение одноатомной
молекулы в пространстве). Система,
состоящая из N
одноатомных
молекул, между которыми нет жестких
связей, имеет 3N
степеней свободы.
Двухатомную
молекулу представим как систему,
состоящую из двух материальных точек.
Если расстояние r
между атомами в молекуле не изменяется
(атомы в молекуле не колеблются и с
увеличением частоты вращения молекула
не растягивается), то число степеней
свободы равно пяти. В самом деле, если
расстояние между атомами
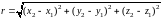 ,
где
,
где
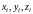 – координаты i-го
атома в молекуле (i
= 1, 2), фиксировано, то всего имеется пять
независимых координат, шестая определяется
из последнего соотношения. Положение
двухатомной молекулы, состоящей из двух
жестко связанных атомов, задают обычно
не пятью декартовыми координатами, а
тремя координатами центра С
(x,
y,
z)
масс молекулы и двумя углами
– координаты i-го
атома в молекуле (i
= 1, 2), фиксировано, то всего имеется пять
независимых координат, шестая определяется
из последнего соотношения. Положение
двухатомной молекулы, состоящей из двух
жестко связанных атомов, задают обычно
не пятью декартовыми координатами, а
тремя координатами центра С
(x,
y,
z)
масс молекулы и двумя углами
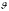 и
и
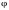 ,
определяющих направление в пространстве
прямой, проходящей через два атома
молекулы. Если
и
неизменны, а изменяются координаты
центра масс, то это указывает на то, что
молекула движется поступательно. Это
дает три поступательные степени свободы
(iпост
= 3). Изменение
же углов
и
при фиксированных координатах центра
масс определяет вращение молекулы
вокруг двух взаимно перпендикулярных
осей
,
определяющих направление в пространстве
прямой, проходящей через два атома
молекулы. Если
и
неизменны, а изменяются координаты
центра масс, то это указывает на то, что
молекула движется поступательно. Это
дает три поступательные степени свободы
(iпост
= 3). Изменение
же углов
и
при фиксированных координатах центра
масс определяет вращение молекулы
вокруг двух взаимно перпендикулярных
осей
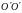 и
и
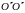 ,
проходящих через центр масс, и
перпендикулярных оси ОО
молекулы (рис. 20).
,
проходящих через центр масс, и
перпендикулярных оси ОО
молекулы (рис. 20).
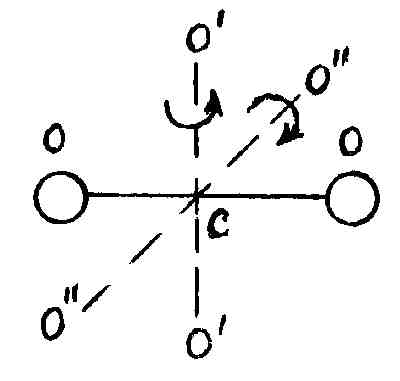
Р и с. 20
Вращение молекулы
вокруг оси ОО не учитывают, так как
энергия этого вращения значительно
меньше двух других (из-за малости моментов
инерции атомов). Поэтому у двухатомной
молекулы две вращательные степени
свободы, т. е.
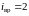 .
Если расстояние между атомами в молекуле
меняется, то это означает, что атомы
колеблются друг относительно друга. В
этом случае у двухатомной нежесткой
молекулы имеется шесть степеней свободы
(
.
Если расстояние между атомами в молекуле
меняется, то это означает, что атомы
колеблются друг относительно друга. В
этом случае у двухатомной нежесткой
молекулы имеется шесть степеней свободы
(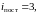
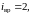
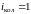 ).
).
Если число атомов
в молекуле
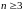 ,
то по динамическим свойствам их делят
на линейные (типа молекул HCN,
CO2
рис. 21) и нелинейные (например, молекула
воды H2O).
,
то по динамическим свойствам их делят
на линейные (типа молекул HCN,
CO2
рис. 21) и нелинейные (например, молекула
воды H2O).
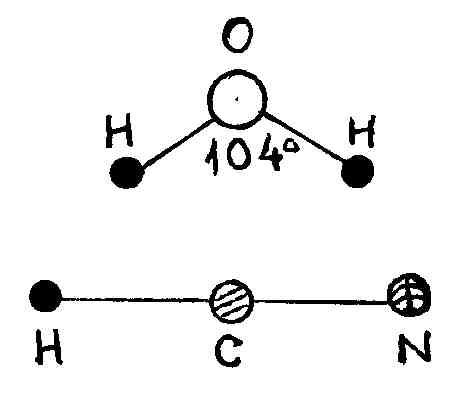
Р и с. 21
В линейных молекулах, в отличие от нелинейных, атомы расположены вдоль одной прямой. Поэтому жесткая линейная молекула содержит столько же степеней свободы, сколько имеет жесткая двухатомная, т. е. пять. Нелинейная жесткая молекула, очевидно, имеет, как и твердое тело, шесть степеней свободы.
Нелинейные молекулы
имеют 3n
– 6
колебательных степеней свободы, так
как из общего числа 3n
степеней свободы три относятся к
поступательному и три к вращательному
движению. У линейной молекулы
существуют две степени свободы
вращательного и три поступательного
движения, поэтому для нее число
колебательных степеней свободы
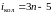 .
Можно доказать, что произвольное
колебательное движение атомов в
нелинейной молекуле всегда можно
представить в виде суммы
.
Можно доказать, что произвольное
колебательное движение атомов в
нелинейной молекуле всегда можно
представить в виде суммы
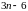 простейших так называемых нормальных
колебаний (и
простейших так называемых нормальных
колебаний (и
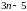 для линейной молекулы). Нормальное
колебание
– гармоническое, при котором все ядра
атомов в молекуле колеблются с одной и
той же частотой и одинаковой фазой, т.
е. одновременно проходят через положение
равновесия. На рис. 22 показаны нормальные
колебания молекулы
для линейной молекулы). Нормальное
колебание
– гармоническое, при котором все ядра
атомов в молекуле колеблются с одной и
той же частотой и одинаковой фазой, т.
е. одновременно проходят через положение
равновесия. На рис. 22 показаны нормальные
колебания молекулы
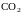 .
Стрелки показывают направление скорости
при колебаниях атомов и приблизительно
величину амплитуды (длина стрелки).
.
Стрелки показывают направление скорости
при колебаниях атомов и приблизительно
величину амплитуды (длина стрелки).
Два нижних колебания вырождены, т. е. имеют одинаковую частоту.
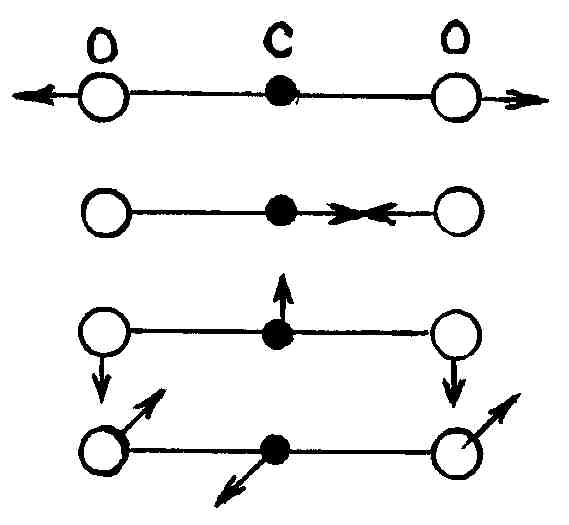
Р и с.22
Кинетическая энергия одноатомной молекулы, имеющей три степени свободы, равна
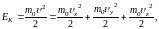 (1.17.1)
(1.17.1)
т. е. содержит столько слагаемых, сколько у нее степеней свободы. Чтобы определить, какая в среднем энергия приходится на одну степень свободы, усредним обе части выражения (1.17.1).
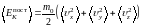 .
(1.17.2)
.
(1.17.2)
Из формул (1.10.31) – (1.10.32) следует, что
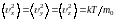 . (1.17.3)
. (1.17.3)
Умножая обе части
равенств (1.17.3) на
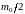 ,
получим
,
получим
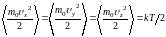 .
(1.17.4)
.
(1.17.4)
Таким образом, на
каждую степень свободы одноатомной
молекулы приходится энергия, равная
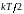 .
Подстановка (1.17.4) в (1.17.2) дает среднюю
кинетическую энергию поступательного
движения одноатомной молекулы:
.
Подстановка (1.17.4) в (1.17.2) дает среднюю
кинетическую энергию поступательного
движения одноатомной молекулы:
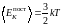 .
(1.17.5)
.
(1.17.5)
Жесткая нелинейная молекула имеет три поступательные и три вращательные степени свободы, поэтому ее кинетическая энергия содержит шесть слагаемых.
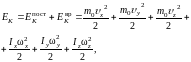 (1.17.6)
(1.17.6)
где
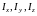 – моменты инерции молекулы относительно
трех декартовых осей координат, проходящих
через центр инерции молекулы;
– моменты инерции молекулы относительно
трех декартовых осей координат, проходящих
через центр инерции молекулы;
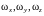 –
проекции угловой скорости вращения
молекулы на те же оси координат.
Аналогичное выражение можно записать
для средних величин:
–
проекции угловой скорости вращения
молекулы на те же оси координат.
Аналогичное выражение можно записать
для средних величин:
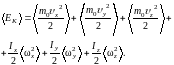 (1.17.7)
(1.17.7)
Установим, какая в среднем энергия приходится на одну вращательную степень свободы. Для этого, как видно из последнего выражения, необходимо вычислить средние квадраты угловой скорости
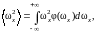 (1.17.8)
(1.17.8)
где
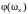 – функция распределения молекул по
проекции угловой скорости. Функция
должна иметь такой же вид, как распределение
Максвелла
,
ибо для нахождения
полностью применимы такие же рассуждения,
какие были сделаны при выводе
.
При этом нужно учесть, что при вращательном
движении роль массы выполняет момент
инерции, а поступательная скорость
– функция распределения молекул по
проекции угловой скорости. Функция
должна иметь такой же вид, как распределение
Максвелла
,
ибо для нахождения
полностью применимы такие же рассуждения,
какие были сделаны при выводе
.
При этом нужно учесть, что при вращательном
движении роль массы выполняет момент
инерции, а поступательная скорость
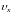 заменяется угловой
заменяется угловой
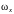 .
Поэтому
.
Поэтому
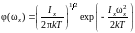 .
(1.17.9)
.
(1.17.9)
Подставляя (1.17.9) в (1.17.8) и выполняя интегрирование, находим
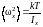 (1.17.10)
(1.17.10)
Аналогично получаем
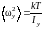 ;
;
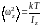 .
(1.17.11)
.
(1.17.11)
Из выражений (1.17.9) и (1.17.10) находим
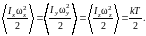 (1.17.12)
(1.17.12)
Таким образом, на каждую вращательную степень свободы приходится такая же энергия , как и на поступательную. При этом кинетическая энергия, которой обладает жесткая нелинейная молекула, согласно выражения (1.17.7), равна
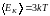 .
(1.17.13)
.
(1.17.13)
Если в многоатомной
молекуле возбуждены колебания атомов
(это наблюдается при температурах
значительно больших комнатных), то на
каждое нормальное колебание молекулы
приходится энергия в два раза большая,
чем на поступательную или вращательную
степень свободы. Это связано с тем, что
при гармонических колебаниях, как
известно из механики, среднее значение
кинетической энергии равно среднему
значению потенциальной энергии; если
на одну степень свободы поступательного
движения приходится кинетическая
энергия
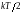 ,
то такая же энергия
,
то такая же энергия
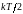 падает и на потенциальную энергию.
Поэтому тепловая энергия, приходящаяся
на одну колебательную степень свободы
молекулы, равна
падает и на потенциальную энергию.
Поэтому тепловая энергия, приходящаяся
на одну колебательную степень свободы
молекулы, равна
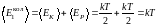 .
(1.17.14)
.
(1.17.14)
Закон равнораспределения тепловой энергии по степеням свободы: если система молекул находится в равновесном газообразном состоянии, то средняя кинетическая энергия, приходящаяся на каждую поступательную, вращательную и колебательную степени свободы его молекул, равна , средняя потенциальная энергия, приходящаяся на каждое нормальное гармоническое колебание атомов в молекуле, также равна .
Закон равнораспределения применим к идеальному газу. Если же газ находится при больших давлениях, то при вычислении полной энергии газа E необходимо учитывать энергию взаимодействия молекул между собой.
