
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
29. Понятие об отрицательных абсолютных температурах.
Отрицательная абсолютная температура, величина, вводимая для описания неравновесных состояний квантовой системы, в которых более высокие уровни энергии более населены, чем нижние. В равновесном состоянии вероятность иметь энергию En определяется формулой:
![]() .
(1)
.
(1)
Здесь Ei — уровни энергии системы, k — постоянная Больцмана, Т — абсолютная температура, характеризующая среднюю энергию равновесной системы U = Σ (WnEn), Из (1) видно, что при Т > 0 нижние уровни энергии более населены частицами, чем верхние. Если система под влиянием внешних воздействий переходит в неравновесное состояние, характеризующееся большей населённостью верхних уровней по сравнению с нижними, то формально можно воспользоваться формулой (1), положив в ней Т < 0. Однако понятие О. т. применимо только к квантовым системам, обладающим конечным числом уровней, так как для создания О. т. для пары уровней необходимо затратить определённую энергию.
В термодинамике абсолютная температура Т определяется через обратную величину 1/Т, равную производной энтропии S по средней энергии системы при постоянстве остальных параметров х:
![]() .
(2)
.
(2)
Из (2) следует, что О. т. означает убывание энтропии с ростом средней энергии. Однако О. т. вводится для описания неравновесных состояний, к которым применение законов равновесной термодинамики носит условный характер.
В более узком смысле О. т.— характеристика степени инверсии населённостей двух выбранных уровней энергии квантовой системы. В случае термодинамического равновесия населённости N1 и N2 уровней E1 и E2 (E1 < E2), т. е. средние числа частиц в этих состояниях связаны формулой Больцмана:
![]() ,
(3)
,
(3)
где Т — абсолютная температура вещества. Из (3) следует, что N2 < N1. Если нарушить равновесие системы, например, воздействовать на систему монохроматическим электромагнитным излучением, частота которого близка к частоте перехода между уровнями: ω21 = (E2 — E1)/ħ и отличается от частот других переходов, то можно получить состояние, при котором населённость верхнего уровня выше нижнего N2 > N1. Если условно применить формулу Больцмана к случаю такого неравновесного состояния, то по отношению к паре энергетических уровней E1 и E2 можно ввести О. т. по формуле:
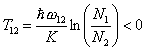 .
(4)
.
(4)
Несмотря на формальный характер этого определения, оно оказывается в ряде случаев удобным, например позволяет описывать флуктуации в равновесных и неравновесных системах с О. т. аналогичными формулами. Понятием О. т. пользуются в квантовой электронике для удобства описания процессов усиления и генерации в средах с инверсией населённости.
30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
Флуктуацией
называют случайное отклонение физических
величин от их средних значений. За
количественную меру флуктуации принимают
среднеквадратическое значение случайной
величины
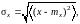
Флуктуации макроскопических величин вызываются беспорядочным тепловым движением молекул, образующих рассматриваемую систему.
Даже в состоянии равновесия наблюдаемые физические величины испытывают флуктуации около своих средних значений. Это легко заметить на опыте при измерении, например, величины давления равновесного состояния газа двумя разными манометрами: быстродействующим (чувствительным) и инерционным (грубым) (рис. 19).
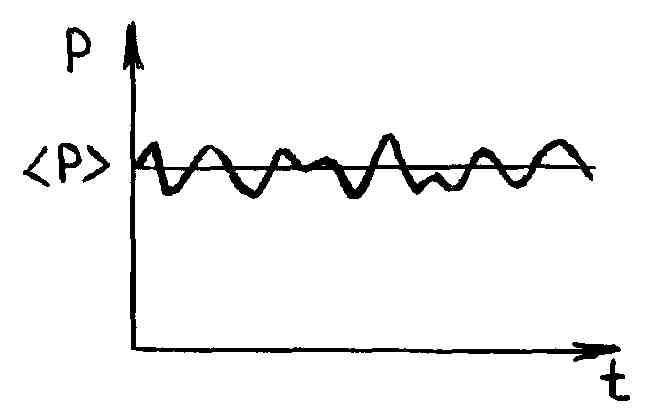
Р и с. 19
Из рис. 19 видно, что инерционный манометр показывает постоянное, равное среднему, давление, тогда как быстродействующий, успевая реагировать на малые изменения действующей на него силы, обнаруживает колебания около среднего значения.
Если система состоит из N невзаимодействующих молекул, то относительная флуктуация любой аддитивной физической величины Ф, значение которой для всей системы в целом равно сумме ее значений φi для всех молекул, убывает обратно пропорционально корню квадратному из числа молекул в системе. Докажем это утверждение.
Рассмотрим аддитивную величину Ф, например, суммарную кинетическую энергию хаотического теплового движения N молекул. Тогда
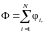
где
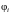 – кинетическая энергия i-й
молекулы. Среднее значение
– кинетическая энергия i-й
молекулы. Среднее значение
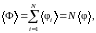 (1.16.1)
(1.16.1)
так
как в состоянии равновесия для одинаковых
молекул их средние равны, т. е.
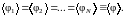
При вычислении дисперсии величины Ф учтем, что дисперсия суммы независимых (невзаимодействующих) величин равна сумме их дисперсий, т. е.
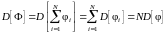 .
(1.16.2)
.
(1.16.2)
Извлекая корень квадратный из обеих частей (1.16.2), получим соотношение для среднеквадратических величин, т. е.
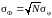 .
(1.16.3)
.
(1.16.3)
Таким образом,
абсолютная флуктуация аддитивной
величины Ф
растет пропорционально
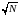 .
Однако важна не абсолютная флуктуация
величины Ф,
существенным является во сколько раз
она меньше среднего значения Ф,
возле которого происходят эти флуктуации,
т. е. имеет значение относительная
флуктуация:
.
Однако важна не абсолютная флуктуация
величины Ф,
существенным является во сколько раз
она меньше среднего значения Ф,
возле которого происходят эти флуктуации,
т. е. имеет значение относительная
флуктуация:
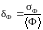 .
(1.16.4)
.
(1.16.4)
Подставляя (1.16.1) и (1.16.3) в (1.16.4), получим
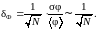 (1.16.5)
(1.16.5)
Из соотношения
(1.16.5) следует, что относительные флуктуации
всех физических величин, значения
которых для всей системы равно сумме
значений их для всех молекул, обратно
пропорционально корню из числа частиц
в системе. Так как число молекул в
макроскопической системе обычно порядка
числа Авогадро (![]() ),
то
),
то
![]() ,
что является ничтожно малой величиной.
Это означает, что величина флуктуации
,
что является ничтожно малой величиной.
Это означает, что величина флуктуации
![]() меньше среднего значения
меньше среднего значения
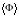 примерно в 1012 раз. Если обратиться к
рис. 19, то такие флуктуации давления
невозможно изобразить ни в каком линейном
масштабе: они просто сольются с прямой,
соответствующей
примерно в 1012 раз. Если обратиться к
рис. 19, то такие флуктуации давления
невозможно изобразить ни в каком линейном
масштабе: они просто сольются с прямой,
соответствующей
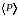 .
Поэтому можно утверждать, что средние
значения макроскопических величин Ф
при большом числе молекул в рассматриваемой
системе совпадают с их истинными
(измеримыми на опыте) значениями. Однако,
если число молекул в рассматриваемой
системе невелико, то истинное значение
Ф
будет существенно отличаться от среднего
значения Ф.
.
Поэтому можно утверждать, что средние
значения макроскопических величин Ф
при большом числе молекул в рассматриваемой
системе совпадают с их истинными
(измеримыми на опыте) значениями. Однако,
если число молекул в рассматриваемой
системе невелико, то истинное значение
Ф
будет существенно отличаться от среднего
значения Ф.
