
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
1. Предмет молекулярной физики. Понятие о микроскопическом и макроскопическом состояниях системы. Основные положения молекулярно-кинетической теории строения вещества. Способы изменения энергии системы.
Молекулярная физика – раздел курса общей физики, в котором изучаются макроскопические свойства вещества, обусловленные его молекулярным строением, характером движения молекул и силами, действующими между ними.
Объектом исследования является система, состоящая из множества молекул.
Предметом исследования является свойства вещества и происходящие в них процессы.
Цель – нахождение зависимости между макроскопическими системами частиц.
Микроскопическое состояние системы — это состояние системы, определяемое заданием координат и импульсов всех составляющих систему частиц.
Макроскопическое состояние системы — это состояние системы, характеризуемое небольшим числом величин (Р, V, T).
T, V, p – макроскопические величины.
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Существуют два способа изменения внутренней энергии системы — совершение механической работы над системой и теплообмен с другими системами.
Первый способ изменения внутренней энергии — совершение механической работы А' внешними силами над системой или самой системой над внешними телами А (А = -А'). При совершении работы внутренняя энергия системы изменяется за счет энергии внешнего источника.
Второй способ изменения внутренней энергии системы (без совершения работы) называется теплообменом (теплопередачей). Количество энергии, полученное или отданное телом при таком процессе, называется количеством теплоты и обозначается ΔQ.
2. Статистический и термодинамический методы изучения систем многих частиц.
В статистическом методе микроскопические величины, характеризующие движение молекулы (к примеру, ее импульс в данный момент времени), являются непредсказуемыми, случайными. Для построения теории создается гипотетическая модель механизма молекулярного движения и пространственного строения вещества. Затем в этой модели разрабатываются методы нахождения плотности вероятностей тех или иных величин, зная которые вычисляют средние значения этих величин.
В термодинамическом методе исследования вещества, в отличие от статистического, не вводятся в рассмотрение какие-либо модельные представления об атомно-молекулярном строении тела, а ставится своей задачей установление зависимости между непосредственно наблюдаемыми макроскопическими (измеряемыми в опыте) величинами, такими как давление, температура, объем, концентрация, напряженность электрического или магнитного поля и т. п. Термодинамика как теоретическая дисциплина строится на трех фундаментальных законах (началах), установленных на основании огромного опытного знания, относящегося к поведению макроскопических систем. Выводы термодинамики имеют весьма общий характер, независимый от выбора гипотетической модели структуры вещества, независимо от характера движения молекул, взаимодействия между ними. Результаты, получаемые в статистической теории, существенным образом зависят от выбора этой гипотетической модели. Недостатком термодинамического метода является невозможность с помощью его вскрыть молекулярную сущность изучаемых явлений. Термодинамика ничего не говорит о механизме происходящих в веществе микропроцессов, а только устанавливает связь между макроскопическими характеристиками вещества. Поэтому в настоящее время в молекулярной физике при исследовании макроскопических свойств вещества разрабатываются оба подхода: статистический и термодинамический. Эти исследования взаимно дополняют друг друга, так как у них один и тот же объект исследования – система, состоящая из многих молекул, и одна и та же цель – нахождение зависимостей между макроскопическими величинами системы частиц.
3. Массы атомов и молекул. Количество вещества.
Так как массы атомов и молекул чрезвычайно малы (10–25–10–27кг), то их удобно измерять не в килограммах, а в специальных относительных единицах. В качестве единичной атомной массы mед принимается двенадцатая часть массы изотопа углерода 12С. Эта величина имеет следующее значение:
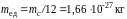 . (1)
. (1)
Относительной
атомной единицей массы
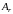 называется отношение массы данного
атома mат
к атомной
единице массы mед,
т. е.
называется отношение массы данного
атома mат
к атомной
единице массы mед,
т. е.
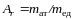 . (2)
. (2)
Величины определяют экспериментально и их значения для химических элементов приведены в таблице Менделеева.
Относительная
молекулярная масса
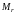 молекулы вычисляется по аналогичной
формуле:
молекулы вычисляется по аналогичной
формуле:
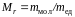 . (3)
. (3)
Относительные молекулярные массы с достаточной точностью могут быть найдены в виде суммы относительных атомных масс, составляющих молекулу. Известно, что масса молекулы меньше составляющих ее масс атомов на величину дефекта массы Δm, который определяется по формуле Эйнштейна Δm = ΔЕ /c2, где ΔЕ – суммарная энергия связи атомов в молекуле, а с – скорость света. Для молекул, содержащих небольшое число атомов ΔЕ ~ 10 эВ = 1,6 ·10–18 Дж этой энергии соответствует дефект массы Δm ~ 10–35 кг, что в сто миллионов раз меньше масс молекул. Поэтому величиной дефекта массы пренебрегают. Зная для данной молекулы, легко найти ее массу
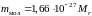 .
(4)
.
(4)
В системе единиц СИ количество вещества выражается в молях. Молем называют количество вещества, содержащее столько частиц (молекул, атомов, электронов, фотонов и т. д.), сколько атомов содержится в 12 г изотопа углерода 12C. Это число называют постоянной Авогадро NA. Согласно определению
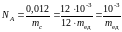 . (5)
. (5)
Учитывая (1), получим
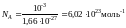 . (6)
. (6)
Массу одного моля называют молярной массой. Очевидно, что молярная масса
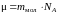 . (7)
. (7)
С учетом (3) и (5), выражение (7) примет вид
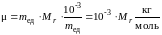 . (8)
. (8)
Число молей связано с числом N молекул, содержащихся в данном количестве вещества, соотношением
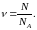 (9)
(9)
Умножив числитель и знаменатель выражения (9) на массу mмол молекулы, получим
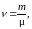 (10)
(10)
где m – масса N молекул вещества.
