
- •Екатеринбург
- •Министерство образования российской федерации
- •Екатеринбург
- •Введение предмет электрометаллургии цветных металлов
- •1. Электродвижущие силы и электродные потенциалы
- •1.2. Теории строения двойного электрического слоя
- •1.3. Электрокапиллярные явления
- •1.4. Химические источники электрической энергии или гальванические элементы
- •1.5. Термодинамика гальванического элемента
- •1.6. Вывод уравнения равновесного электродного потенциала
- •Величина скачка потенциалов
- •1.7. Классификация электродов
- •1.8. Электроды сравнения
- •1.9. Стандартный, условный стандартный и равновесный потенциалы
- •1.10. Ряд напряжений металлов
- •1.11.Примеры решения задач и контрольные задания
- •Термодинамические характеристики веществ, ккал/моль
- •Индивидуальные контрольные задания
- •1.11.2.Определение термодинамических характеристик веществ по температурной зависимости эдс
- •Индивидуальные контрольные задания
- •Индивидуальные контрольные задания
- •1.11.4. Расчет величин равновесных потенциалов в водных растворах
- •Индивидуальные контрольные задания
- •1.11.5. Нахождение неизвестных окислительно-восстановительных потенциалов по правилу Лютера
- •Индивидуальные контрольные задания
- •1.11.6. Расчет равновесных концентраций ионов разной валентности
- •Индивидуальные контрольные задания
- •1.12.Контрольные вопросы
- •2. Кинетика электродных процессов
- •2.1.Поляризация электродов. Основные виды поляризации
- •2.2. Электрохимическая поляризация
- •Показатели разряда ионов водорода на различных металлах
- •2.3. Концентрационная поляризация
- •2.4. Полярографический анализ. Ток и потенциал полуволны
- •2.5. Перенапряжение химической реакции
- •2.6. Фазовая поляризация
- •2.7. Примеры решения задач и задания
- •2.7.1.Определение величины электрохимической поляризации
- •Индивидуальные контрольные задания
- •2.7.2. Определение тока обмена и коэффициента переноса
- •Индивидуальные контрольные задания
- •Вариант 1 2 3 4 5 6 7 8 9 10
- •2.7.3.Определение предельного тока разряда ионов по характеристикам диффузии и миграции ионов
- •Индивидуальные контрольные задания
- •Группа 1 п ш
- •2.7.4. Определение величины концентрационной поляризации
- •Индивидуальные контрольные задания
- •2.8. Контрольные вопросы
- •3.1. Сущность электролиза. Катодные и анодные процессы. Основные законы электролиза
- •3.2.Характеристики электролиза
- •3.3. Катодные процессы
- •3.4. Совместный разряд ионов
- •3.5. Анодные процессы
- •3.6. Примеры решения задач и задания
- •3.6.1. Совместный разряд ионов металла и водорода
- •Индивидуальные контрольные задания
- •3.7. Контрольные вопросы
- •4. Основы гидроэлектрометаллургии цветных металлов
- •4.1. Основы электрорафинирования меди
- •4.2. Электролитическое рафинирование серебра
- •4.3. Электролитическое рафинирование золота
- •4.4. Электрорафинирование свинца
- •Расход электроэнергии - 120-200 кВтч/т.
- •4.5. Электрорафинирование висмута
- •4.6. Электрорафинирование олова
- •4.7. Электрометаллургия никеля
- •Условия и результаты электрорафинирования никеля
- •5.8. Основы электрометаллургии кобальта
- •4.9. Основы гидроэлектрометаллургии цинка
- •Баланс напряжения цинковых электролизеров
- •4.10. Контрольные вопросы
- •6. Химические источники электрической энергии
- •6.1. Важнейшие характеристики хиээ
- •6.2. Основные типы хиээ
- •6.3. Топливные элементы
- •6.4. Аккумуляторы
- •6.5. Саморазряд и сохранность хиээ
- •6.6. Контрольные вопросы
- •Оглавление
- •Основные законы электролиза 45
1.3. Электрокапиллярные явления
Электрокапиллярные явления основаны на зависимости поверхностного натяжения от заряда поверхности. Из-за увеличения сил электростатического отталкивания поверхностное натяжение должно уменьшаться с увеличением как положительного, так и отрицательного заряда поверхности электрода. Электрокапиллярные кривые определяют с высокой точностью экспериментально на ртутных электродах (рис.1.7).

0,5 0 -0,5 -1,0 -1,5
Рис.1.7. Вид электрокапиллярной кривой:
1-электрокапиллярная кривая (э.к.к);
2-зависимость плотности заряда от потенциала;
3-зависимость емкости ДЭС от потенциала
Зависимости 2 и 3 рассчитываются по зависимости 1; и связаны уравнениями Липмана:
=-![]() C=
C=![]() .
.
С другой стороны, емкость ДЭС (С) можно определить экспериментально компенсационным методом (рис.1.8) на переменном токе частотой 20кГц и более.
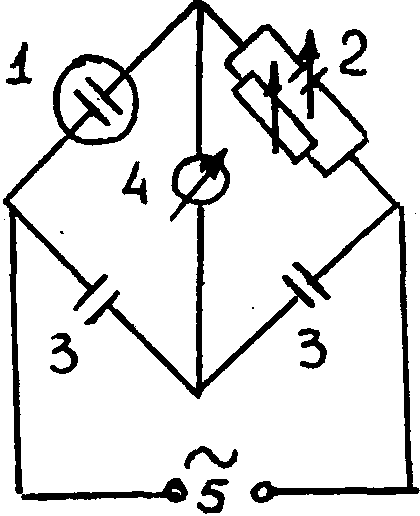
Рис.1.8. Мостовая схема для измерения емкости ДЭС:
1- исследуемая э/х ячейка; 2- переменные емкость и сопротивление;
3- постоянные емкости; 4 - индикатор (осциллограф, ламповый вольтметр); 5- генератор переменного тока
Хорошее согласие емкости экспериментальной и рассчитанной по э.к.к., -убедительное доказательство правильности представлений о ДЭС.С=16-20 мкф/см2 - ионный слой образован катионами; С = 35-36 мкф/см2 - более деформированными анионами (10-6-10-7см).
Электроосмос - перемещение жидкости в капиллярах под действием внешнего электрического поля.
Электрофорез - мелкие частицы имеют заряд и могут ускоряться внешним электрическим полем, что, например, используется для ускорения отделения Me и шлака (Ю.П. Никитин).
Пульсирующий ток, неравномерная поляризация — все эти явления убедительно доказывают существование двойного электрического слоя и скачка потенциалов на границе раздела металл-электролит.
1.4. Химические источники электрической энергии или гальванические элементы
Под химическим источником электрической энергии, или гальваническим элементом, понимают электрохимическую систему, состоящую из двух различных электродов, помещенных в электролит.
Пример: элемент Якоби (рис.1.9). На электродах протекают полуреакции (электродные процессы):
на Zn-электроде Zn-2e = Zn2+
на Сu-электроде Cu2+ + 2e = Cu.
Появление ЭДС осуществляется за счет химической реакции вытеснения:
Zn + CuSО4= Сu + ZnSО4
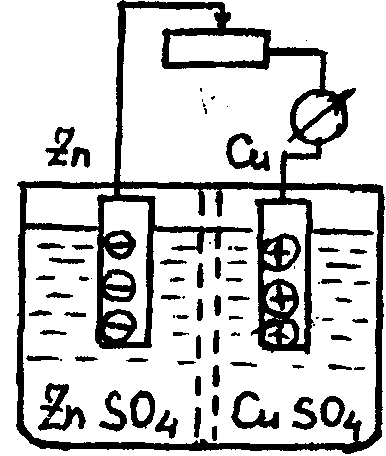
Рис.1.9. Принципиальное устройство химического источника тока
При большом R ток в цепи приближается к нулю, а Е - к Еравн. Гальванический элемент выделяет электрическую энергию во внешнюю цепь за счет химической реакции.
Изображают гальванический элемент согласно ЮПАК:
(-)Me|Zn|ZnSО4,H2О||CuSО4,H2О|Cu|Me(+)
Если в цепь рис.1.9 установить внешний источник тока обратного направления, то на электродах элемента Якоби-Даниэля пойдут те же реакции, но в обратном направлении:
на Zn-электроде: Zn2++2e=Zn,
на Сu- электроде: Сu - 2е = Сu2+.
Токообразующая реакция остается прежней, но сменит направление:
Сu + ZnSО4 = CuSО4 + Zn.
Такой гальванический элемент называют обратимым.
Если при пропускании тока в различных направлениях на электродах протекают различные электродные процессы, такой гальванический элемент является необратимым (его не восстановить как аккумуляторы подзарядкой).
Пример. Вольтов столб Zn|H2SО4|Cu
Реакции на электродах:
прямая обратная
на Zn: Zn-2e = Zn2+ 2Н+ + 2е = Н2
на Сu: 2Н+ + 2е = Н2 Сu - 2е = Сu2+
Zn+H2SО4=ZnSО4+H2 Cu+H2SО4=CuSО4+H2
Задача электрохимии - установить электродные процессы, токообразующую реакцию, ее обратимость. Помогает термодинамика, устанавливающая связь величины ЭДС с изменением энергии Гиббса токообразующей реакции.
