
- •Екатеринбург
- •Министерство образования российской федерации
- •Екатеринбург
- •Введение предмет электрометаллургии цветных металлов
- •1. Электродвижущие силы и электродные потенциалы
- •1.2. Теории строения двойного электрического слоя
- •1.3. Электрокапиллярные явления
- •1.4. Химические источники электрической энергии или гальванические элементы
- •1.5. Термодинамика гальванического элемента
- •1.6. Вывод уравнения равновесного электродного потенциала
- •Величина скачка потенциалов
- •1.7. Классификация электродов
- •1.8. Электроды сравнения
- •1.9. Стандартный, условный стандартный и равновесный потенциалы
- •1.10. Ряд напряжений металлов
- •1.11.Примеры решения задач и контрольные задания
- •Термодинамические характеристики веществ, ккал/моль
- •Индивидуальные контрольные задания
- •1.11.2.Определение термодинамических характеристик веществ по температурной зависимости эдс
- •Индивидуальные контрольные задания
- •Индивидуальные контрольные задания
- •1.11.4. Расчет величин равновесных потенциалов в водных растворах
- •Индивидуальные контрольные задания
- •1.11.5. Нахождение неизвестных окислительно-восстановительных потенциалов по правилу Лютера
- •Индивидуальные контрольные задания
- •1.11.6. Расчет равновесных концентраций ионов разной валентности
- •Индивидуальные контрольные задания
- •1.12.Контрольные вопросы
- •2. Кинетика электродных процессов
- •2.1.Поляризация электродов. Основные виды поляризации
- •2.2. Электрохимическая поляризация
- •Показатели разряда ионов водорода на различных металлах
- •2.3. Концентрационная поляризация
- •2.4. Полярографический анализ. Ток и потенциал полуволны
- •2.5. Перенапряжение химической реакции
- •2.6. Фазовая поляризация
- •2.7. Примеры решения задач и задания
- •2.7.1.Определение величины электрохимической поляризации
- •Индивидуальные контрольные задания
- •2.7.2. Определение тока обмена и коэффициента переноса
- •Индивидуальные контрольные задания
- •Вариант 1 2 3 4 5 6 7 8 9 10
- •2.7.3.Определение предельного тока разряда ионов по характеристикам диффузии и миграции ионов
- •Индивидуальные контрольные задания
- •Группа 1 п ш
- •2.7.4. Определение величины концентрационной поляризации
- •Индивидуальные контрольные задания
- •2.8. Контрольные вопросы
- •3.1. Сущность электролиза. Катодные и анодные процессы. Основные законы электролиза
- •3.2.Характеристики электролиза
- •3.3. Катодные процессы
- •3.4. Совместный разряд ионов
- •3.5. Анодные процессы
- •3.6. Примеры решения задач и задания
- •3.6.1. Совместный разряд ионов металла и водорода
- •Индивидуальные контрольные задания
- •3.7. Контрольные вопросы
- •4. Основы гидроэлектрометаллургии цветных металлов
- •4.1. Основы электрорафинирования меди
- •4.2. Электролитическое рафинирование серебра
- •4.3. Электролитическое рафинирование золота
- •4.4. Электрорафинирование свинца
- •Расход электроэнергии - 120-200 кВтч/т.
- •4.5. Электрорафинирование висмута
- •4.6. Электрорафинирование олова
- •4.7. Электрометаллургия никеля
- •Условия и результаты электрорафинирования никеля
- •5.8. Основы электрометаллургии кобальта
- •4.9. Основы гидроэлектрометаллургии цинка
- •Баланс напряжения цинковых электролизеров
- •4.10. Контрольные вопросы
- •6. Химические источники электрической энергии
- •6.1. Важнейшие характеристики хиээ
- •6.2. Основные типы хиээ
- •6.3. Топливные элементы
- •6.4. Аккумуляторы
- •6.5. Саморазряд и сохранность хиээ
- •6.6. Контрольные вопросы
- •Оглавление
- •Основные законы электролиза 45
3.2.Характеристики электролиза
Процесс электролиза характеризуется величинами напряжения разложения, обратной ЭДС, рабочего напряжения, выхода по току, выхода по энергии, удельного расхода электроэнергии.
Минимальное значение напряжения, которое необходимо приложить к электродам, чтобы начался процесс электролиза с образованием электродных продуктов, называется напряжением разложения (Ен.р.).
Методика определения напряжения разложения по кривым i- и i-U показана на рис 3.2.
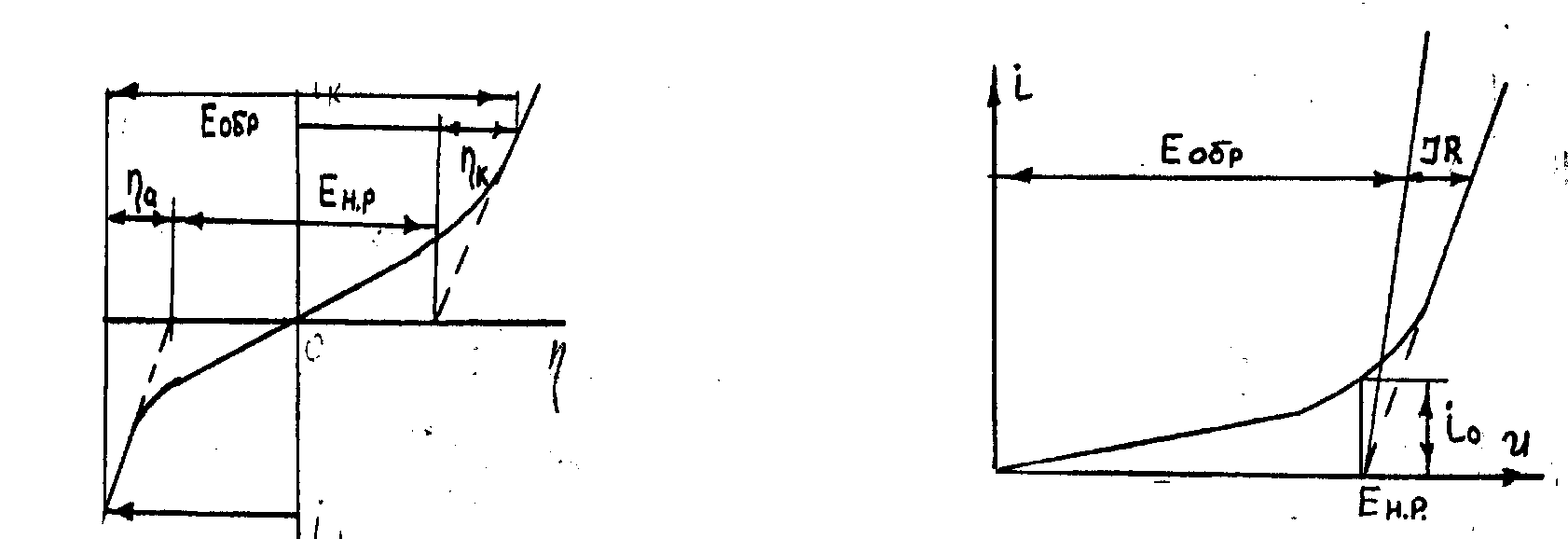
а б
Рис.3.2. Вид поляризационных кривых в координатах
i - (a), i- U (б)
Напряжение разложения может быть также найдено как разность равновесных потенциалов для электродных реакций, реализующихся на аноде и катоде.
Ен.р может быть вычислено и по величинам изменения энергии Гиббса Gр соответствующей электрохимической реакции
Ен.р
= Ен.р.
=
![]() . (3.7)
. (3.7)
Величина обратной ЭДС (Еобр.) при определенных ia и iк включает в себя напряжение разложения и величины катодной и анодной поляризаций при рассматриваемых плотностях тока (рис.3.2):
Еобр=Ен.р +а+к. (3.8)
С другой стороны величина обратной ЭДС равняется рабочему напряжению на электролизере за вычетом омического падения напряжения в электролите и электродах: IR= IRэл + IRэд (pиc.3.3).
Еобр=Uр-IR. (3.9)
Обратная ЭДС определяется в момент отключения тока электролиза (рис.3.3). Величина же рабочего напряжения равна
Up = Ен.р+ к + а + IRэл+ IRэд+ IRпр , (3.10)
где IRпр - падение напряжения в подводящих проводах (ошиновке электролизера).
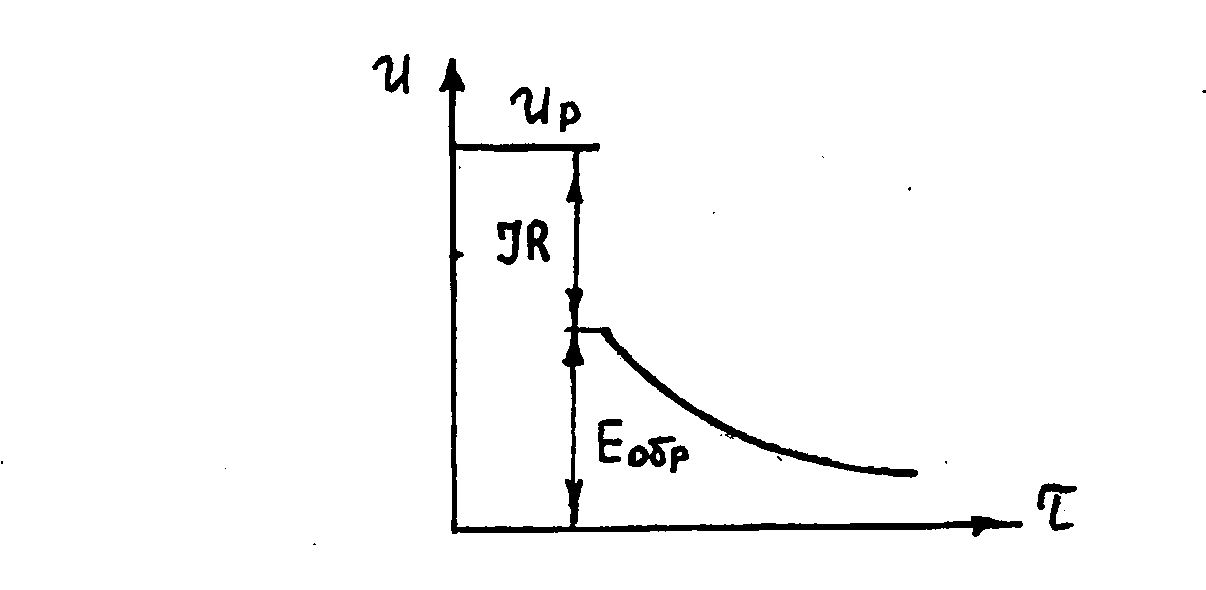
Рис.3.3. Принцип определения обратной ЭДС
Важнейшей характеристикой процесса электролиза является величина выхода по току.
Выходом по току т называется отношение количества вещества, фактически образовавшегося на электроде (mфакт), к количеству вещества, которое должно было бы образоваться в соответствии с законом Фарадея (mтеор).
Выход по току выражается в долях единицы либо в процентах:
т=
![]() либо
100%.
(3.11)
либо
100%.
(3.11)
Значение mфакт определяется взвешиванием, mт рассчитывается по уравнению (3.4). Выход по току, как правило, не равен 100%, потому что часть тока расходуется на побочные процессы (iпоб):
т
=
![]() . (3.12)
. (3.12)
В частности, на разложение более легко восстановимых веществ расходуется остаточный ток io (см.рис.3.2). В том случае, если это единственный побочный процесс, выход по току при определенной плотности тока i может быть найден по уравнению
т
=![]() . (3.13)
. (3.13)
Доля тока, расходуемая на побочные реакции, в принципе не одинакова для катодного и анодного процессов, поэтому различают катодный и анодный выходы по току. Необходимо также помнить, что выход по току, строго говоря, не остается постоянным во времени, а изменяется с изменением условий электролиза, поэтому различают выходы по току интегральный (усредненный за все время электролиза) и парциальный (в определенный момент).
Выход по току характеризует эффективность использования по назначению тока электролиза. Для характеристики эффективности использования электроэнергии применяют показатели удельного расхода электроэнергии (Wф) и выхода по энергии (э).
Под удельным расходом электроэнергии (Wф) понимают ее количество, затраченное на получение единицы массы продукта электролиза:
Wф=
![]() .
(3.14)
.
(3.14)
Поскольку mф = mт т = qIт, получаем
Wф=
![]() =
=![]() .
(3.15)
.
(3.15)
Таким образом, величина фактического расхода электроэнергии определяется величиной рабочего напряжения, электрохимического эквивалента и выхода по току.
Выход по энергии (э) равен отношению минимально возможного удельного расхода электроэнергии на получение данного целевого продукта Wт к реальному или фактическому удельному расходу электроэнергии Wф :
э
=
![]() .
(3.16)
.
(3.16)
По аналогии с уравнением (3.15) для минимально возможного удельного расхода энергии (Up = Ен.р, т = 1) справедливо уравнение
WТ=
![]() . (3. 17)
. (3. 17)
Подставив уравнения (3.15) и (3.17) в (3.16), имеем
э
=
![]() .
(3.18)
.
(3.18)
Видно, что эффективность использования электроэнергии определяется в равной степени как эффективностью использования тока (т), так и рациональным использованием рабочего напряжения (Ен.р/Up). Это определяет значимость обоснованной минимизации всех составляющих рабочего напряжения (уравнение (3.10)), исключения либо сведения к минимуму побочных электрохимических процессов (уравнение (3.12)).
Рассмотренные показатели являются методологической основой для исследования и совершенствования реальных электрохимических процессов.
