
- •Екатеринбург
- •Министерство образования российской федерации
- •Екатеринбург
- •Введение предмет электрометаллургии цветных металлов
- •1. Электродвижущие силы и электродные потенциалы
- •1.2. Теории строения двойного электрического слоя
- •1.3. Электрокапиллярные явления
- •1.4. Химические источники электрической энергии или гальванические элементы
- •1.5. Термодинамика гальванического элемента
- •1.6. Вывод уравнения равновесного электродного потенциала
- •Величина скачка потенциалов
- •1.7. Классификация электродов
- •1.8. Электроды сравнения
- •1.9. Стандартный, условный стандартный и равновесный потенциалы
- •1.10. Ряд напряжений металлов
- •1.11.Примеры решения задач и контрольные задания
- •Термодинамические характеристики веществ, ккал/моль
- •Индивидуальные контрольные задания
- •1.11.2.Определение термодинамических характеристик веществ по температурной зависимости эдс
- •Индивидуальные контрольные задания
- •Индивидуальные контрольные задания
- •1.11.4. Расчет величин равновесных потенциалов в водных растворах
- •Индивидуальные контрольные задания
- •1.11.5. Нахождение неизвестных окислительно-восстановительных потенциалов по правилу Лютера
- •Индивидуальные контрольные задания
- •1.11.6. Расчет равновесных концентраций ионов разной валентности
- •Индивидуальные контрольные задания
- •1.12.Контрольные вопросы
- •2. Кинетика электродных процессов
- •2.1.Поляризация электродов. Основные виды поляризации
- •2.2. Электрохимическая поляризация
- •Показатели разряда ионов водорода на различных металлах
- •2.3. Концентрационная поляризация
- •2.4. Полярографический анализ. Ток и потенциал полуволны
- •2.5. Перенапряжение химической реакции
- •2.6. Фазовая поляризация
- •2.7. Примеры решения задач и задания
- •2.7.1.Определение величины электрохимической поляризации
- •Индивидуальные контрольные задания
- •2.7.2. Определение тока обмена и коэффициента переноса
- •Индивидуальные контрольные задания
- •Вариант 1 2 3 4 5 6 7 8 9 10
- •2.7.3.Определение предельного тока разряда ионов по характеристикам диффузии и миграции ионов
- •Индивидуальные контрольные задания
- •Группа 1 п ш
- •2.7.4. Определение величины концентрационной поляризации
- •Индивидуальные контрольные задания
- •2.8. Контрольные вопросы
- •3.1. Сущность электролиза. Катодные и анодные процессы. Основные законы электролиза
- •3.2.Характеристики электролиза
- •3.3. Катодные процессы
- •3.4. Совместный разряд ионов
- •3.5. Анодные процессы
- •3.6. Примеры решения задач и задания
- •3.6.1. Совместный разряд ионов металла и водорода
- •Индивидуальные контрольные задания
- •3.7. Контрольные вопросы
- •4. Основы гидроэлектрометаллургии цветных металлов
- •4.1. Основы электрорафинирования меди
- •4.2. Электролитическое рафинирование серебра
- •4.3. Электролитическое рафинирование золота
- •4.4. Электрорафинирование свинца
- •Расход электроэнергии - 120-200 кВтч/т.
- •4.5. Электрорафинирование висмута
- •4.6. Электрорафинирование олова
- •4.7. Электрометаллургия никеля
- •Условия и результаты электрорафинирования никеля
- •5.8. Основы электрометаллургии кобальта
- •4.9. Основы гидроэлектрометаллургии цинка
- •Баланс напряжения цинковых электролизеров
- •4.10. Контрольные вопросы
- •6. Химические источники электрической энергии
- •6.1. Важнейшие характеристики хиээ
- •6.2. Основные типы хиээ
- •6.3. Топливные элементы
- •6.4. Аккумуляторы
- •6.5. Саморазряд и сохранность хиээ
- •6.6. Контрольные вопросы
- •Оглавление
- •Основные законы электролиза 45
2.3. Концентрационная поляризация
При диффузионной кинетике скорость реакции определяется доставкой (замедленной диффузией) веществ к фронту электрохимической реакции или от него, а поляризация электродов определяется изменением концентрации в приэлектродном слое. В соответствии с уравнением Нернста потенциал электрода под током Е определяется активностью его ионов у поверхности электрода под током (ais), а равновесный потенциал (Ер) - активностью ионов в объеме электролита под током i (ai):
Е = Е° + lnais, (2.21)
Ep = E° + lnai. (2.22)
Разность уравнений (2.21) и (2.22) дает уравнение концентрационной поляризации (к):
к=
Е - Ер
=
ln![]() =
ln
=
ln![]() ,
(2.23)
,
(2.23)
поскольку коэффициенты активности при небольших градиентах концентрации практически постоянны.
Распределение концентраций в приэлектродном слое при различных плотностях тока (i3 >i2>i1) показано на рис.2.4.
В пределах диффузионного слоя д концентрация изменяется от объемной (ci) до приэлектродной (cis).Толщина диффузионного слоя (10-2см) заметно превышает толщину диффузной части двойного электрического слоя (10-5-10-7см).

Рис.2.4. Распределение концентраций в приэлектродном слое
при электролизе
С увеличением плотности тока приэлектродная концентрация уменьшается, достигая нулевого значения при плотности тока, равной предельной диффузионной i пр.
Действительно, воспользовавшись уравнением Фика, можно записать
i
= nFD![]() . (2.24)
. (2.24)
При постоянных D,сi,д увеличение плотности тока приводит к уменьшению приэлектродной концентрации (cis). При сis =0 ток соответствует предельному диффузионному (inp):
inp,=
![]() сi,
(2.25)
сi,
(2.25)
Разделив левые и правые части выражений (2.24) и (2.25) друг на друга, получаем
![]() =
ci
-
= 1 -
,
откуда
=
ci
-
= 1 -
,
откуда
= l - . (2.26)
Подставив это выражение в (2.23), получаем уравнение концентрационной поляризации для катодного процесса:
к=
In
(l-![]() ).
(2.27)
).
(2.27)
Величина концентрационной поляризации становится заметной лишь при плотностях тока, близких к предельной диффузионной: при i = 0,9 inp = 2,3 , при i = 0,99inp = 2 2,3 , при i=0,999 inp = 3 2,3 .
Для анодного процесса приэлектродная концентрация (cis) тем выше объемной (сi), чем больше анодная плотность тока:
ia = ( cis- ci). (2.28)
Разделив уравнение (2.28) на (2.25), получаем
![]() =
=
![]() ,
откуда
,
откуда
= 1 + (2.29)
Подставив (2.29) в (2.23), получаем уравнение концентрационной поляризации для анодного процесса:
а = ln(l + ), (2.30)
где inp.к - предельный диффузионный ток для катодного процесса.
При а > 2,3 наблюдается прямопропорциональная зависимость между а и lg iа (рис.2.5) типа Тафелевской:
а = lnia - lniпр.к (2.31)

Рис.2.5.Графическое изображение концентрационной поляризации
В целом величина предельного диффузионного тока зависит от объемной концентрации сi, коэффициента диффузии D, толщины диффузионного слоя д и чисел переноса t+.
Зависимость inp от D и д рассматривает теория конвективной диффузии, разработанная В.Г.Левичем. Строгое выражение для iпр.к получено для вращающегося дискового электрода:
inp=nFD2/3-1/6 1/2 сi , (2.32)
где - кинематическая вязкость электролита;
- угловая скорость вращения.
Зависимость inp от угловой скорости вращения в степени 1/2 используют для распознания диффузионной природы электрохимической реакции.
В том случае когда разряжающиеся ионы участвуют в переносе тока (нет, либо мало фонового электролита), необходимо учитывать влияние на inp миграции ионов через числа переноса (t+ - доля тока, переносимая данным видом ионов). При этом необходимо рассматривать два случая: первый - когда направления потоков диффузии и миграции совпадают. Этот случай имеет место при разряде на катоде положительно заряженных ионов, например Cd2+ (рис.2.6).
Поскольку общий поток разрядившихся ионов обеспечивается диффузией и миграцией, можно записать
Vразр= Vдиф + Vмиг;
![]() ;
;
откуда
i=
![]() ;
;
iпр=
![]() .
(2.33)
.
(2.33)
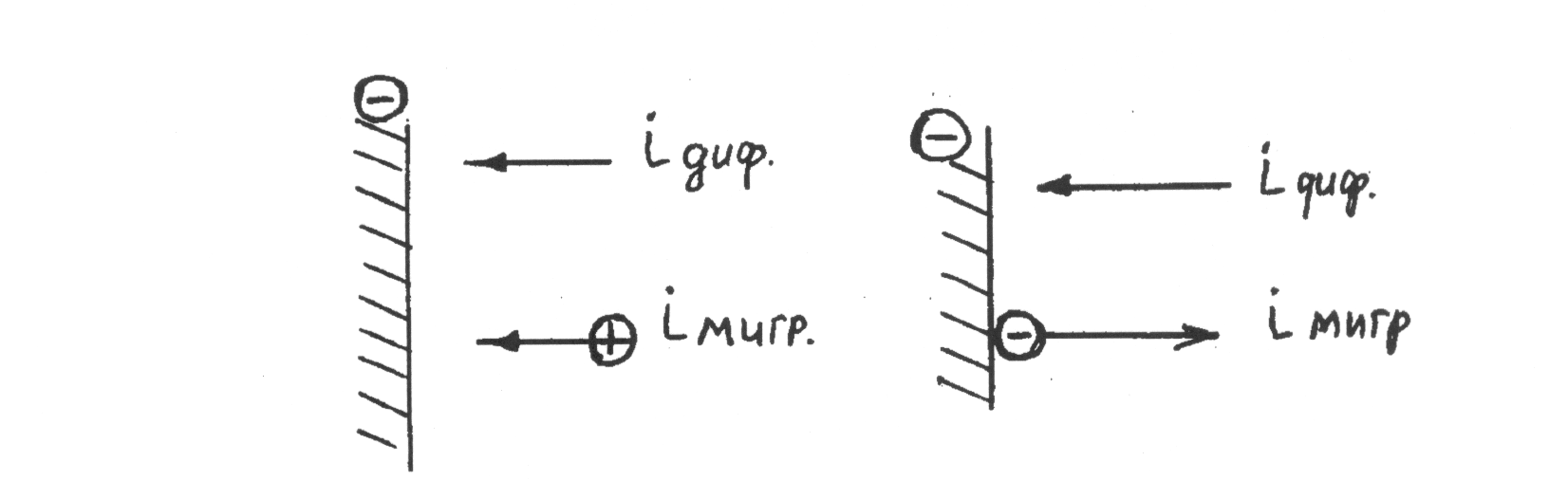
а б
Рис.2.6. Потоки диффузии i диф и миграции iмигр:
а - совпадающие; б – противоположные
Таким образом, в рассматриваемом случае миграция ионов увеличивает inp
При разряде на катоде отрицательно заряженных ионов, например Cd(CN)3-, направления потоков диффузии и миграции будут противоположными (рис.2.6, б):
Vразр = Vдиф - Vмигр
и миграция ионов уменьшает величину inp:
inp=
![]() .
(2.34)
.
(2.34)
Таким образом, для учета миграции необходимо знать заряд разряжающихся ионов и числа переноса.
