
- •Теоретична частина
- •Загальна характеристика s-елементів і групи
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Утворення та застосування лужних металів
- •Загальна характеристика s-елементів іі групи
- •1.6. Властивості та застосування берилію, магнію, лужноземельних металів та їх сполук
- •Кальцій і його сполуки
- •І та іі груп пс
- •Запитання для самоконтролю і контролю знань
- •Приклади розв’язання задач для самостійної роботи
- •Завдання для самоконтролю
- •5. Експериментальна частина
Приклади розв’язання задач для самостійної роботи
1. Лужноземельний метал масою 10 г окислили хлором. При цьому одержали 27,75 г його хлориду. Визначте метал.
Лужноземельні метали в сполуках проявляють ступінь окиснення +2. Якщо метал позначимо Ме, то формула хлориду буде МеCl2. Молярну масу металу позначимо х г/моль. Тоді молярна маса металу (х+71) г/моль. Реакція відбувається за рівнянням:
10г 27,75г
Ме + Cl2 = МеCl2
х г (х+71)г
Складаємо алгебраїчне рівняння:
10(х + 71) = 27,75х; х = 40.
Це лужноземельний метал кальцій.
2. Маса твердого залишку, утвореного після прожарювання до постійної маси суміші кальцій гідроксиду та кальцій карбонату, зменшилась на 40% порівняно з масою вихідної суміші. Обчисліть масові частки (%) речовин у вихідній суміші.
Припустимо, що маємо 100 г суміші, яка містить х г Са(ОН)2 та (100 – х)г СаСО3. Маса суміші після прожарювання зменшилась на 40%, тобто на 40 г тому, що обидві речовини розкладуться з виділенням газоподібних речовин Н2О і СО2. За рівняннями реакцій розрахуємо маси водяних парів та вуглекислого газу, які виділяться під час термолізу суміші:
х г а г
Са(ОН)2 = СаО + Н2О;
74 г 18 г
(100 – х)г b г
СаСО3 = СаО + СО2;
100 г 44 г
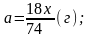



Звідси х = 20,32 г.
Розрахуємо масові частки Са(ОН)2 та СаСО3 в 100 г суміші:
ω(%) (Са(ОН)2) =
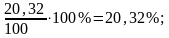
ω(%) (СаСО3) = 100 – 20,32 = 79,68%.
3. Розчин магній нітрату об’ємом 500 мл містить 1,6 моль солі, ступінь дисоціації якої 90%. Розрахуйте маси катіонів та нітрат-аніонів, що містяться в 1,5 л такого ж розчину.
Якщо
в 500 мл розчину магній нітрату міститься
1,6 моль солі, то в 1,5 л його:
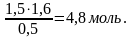
Виходячи з того, що ступінь дисоціації визначається:
α =
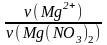 ,
,
ν(Mg2+) = 0,9 ∙ 4,8 = 4,32 моль; тоді m(Mg2+) = 4,32 ∙ 24 = 103,68 г;
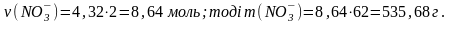
Завдання для самоконтролю
Рівень А
1. Окисненням лужного металу масою 70 г одержали 150 г його оксиду. Визначте метал.
2. Визначте масу калію, яку необхідно використати для приготування 200 г розчину калій гідроксиду з масовою часткою лугу 10%.
3. У воді об’ємом 0,5 л розчинили 0,75 моль калію. Який об’єм (н.у.) водню при цьому виділився?
Рівень В
1. Лужноземельний метал масою 25 г окислили киснем повітря. Добутий оксид розчинили у воді. Утворилось 46,25 г гідроксиду. Який метал використали?
2. При термічному розкладі суміші магній оксиду та магній карбонату масою 58,4 г одержали 32 г твердого залишку. Обчисліть масову частку (%) магній оксиду у вихідній суміші.
3. Приготували 800 мл розчину кальцій хлориду, що містить 2,5 моль солі, ступінь дисоціації якої дорівнює 85%. Визначте маси катіонів кальцію та аніонів хлору в 400 мл цього розчину.
Рівень С
1. При електролізі розплаву 4 г бінарної речовини на аноді виділилось 1,12 л водню (н.у.). Визначте формулу речовини. Чи можна провести електроліз водного розчину цієї речовини?
2. Сплав натрію та калію масою 0,15 г розчинили у воді. При цьому одержали 300 мл розчину із вмістом гідроксид-іонів 1,82∙10-2 моль/л. Визначте масові частки металів (%) у вихідному сплаві.
3. Суміш натрій гідроксиду та натрій гідрогенкарбонату масою 66,4 г прожарили при температурі 2600С. Маса одержаної суміші виявилась на 13,4 г меншою від маси вихідної суміші. Розрахуйте масові частки (%) речовин у вихідній суміші.
