
- •Теоретична частина
- •Загальна характеристика s-елементів і групи
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Утворення та застосування лужних металів
- •Загальна характеристика s-елементів іі групи
- •1.6. Властивості та застосування берилію, магнію, лужноземельних металів та їх сполук
- •Кальцій і його сполуки
- •І та іі груп пс
- •Запитання для самоконтролю і контролю знань
- •Приклади розв’язання задач для самостійної роботи
- •Завдання для самоконтролю
- •5. Експериментальна частина
Кальцій і його сполуки
Кальцій – сріблясто-білий метал, який плавиться при температурі 8500С. Він значно міцніший і твердіший, ніж лужні метали, але також активний метал. Так, за звичайних умов він реагує з киснем повітря, водою, галогенами:
2Са + О2 = 2СаО; 2СаО + 2H2O = Са(ОН)2 + Н2; Са + Cl2 = СаCl2.
З іншими неметалами і воднем взаємодіє при нагріванні:
3Са + N2 = Ca3N2; Ca + S = CaS; 3Ca + 2P = Ca3P2; Ca + H2 = CaH2.
Кальцій здатен віднімати кисень або галогени від оксидів або галогенідів менш активних металів:
2Са + ТіО2 = 2СаО + Ті; 2Са + ТіCl 4 = 2СаCl2 + Ті.
Із сполук кальцію, які найбільш широко використовуються, варто виділити СаСО3, СаSО4, Са3(РО4)2 і СаCl2.
Кальцій карбонат СаСО3 – головна складова частина вапняку, крейди, мармуру. Із вапняку виготовляють вапно (негашене, гашене і хлорне). В значних кількостях вапняк використовується в металургії як флюс.
Кальцій карбонат, який входить до складу природних гірських порід, під дією води та карбон (ІV) оксиду частково переходить в розчин у вигляді кальцій гідрогенкарбонату СаСО3 + СО2 + Н2О = Са(НСО3)2 і переноситься підземними та річними водами на великі відстані.
Природна вода, яка містить в розчині значну кількість іонів Са2+ і Мg2+ у вигляді солей Са (або Мg), називається твердою.
Тверда вода утворює в парових котлах та котельних установках шар накипу за реакцією: Са(НСО3)2 = СаСО3↓ + СО2↑ + Н2О. Накип погано проводить електричний струм, викликає збільшення витрат пального і прискорює винашування парових котлів і котельних установок.
Для узагальнення знань з властивостей розглянутих s-елементів І та ІІ груп ПС та їх сполук складемо таблицю.
Таблиця 12.3 Узагальнення властивостей s-елементів
І та іі груп пс
Характеристика елементів і їх сполук |
Лужні метали |
Ве, Мg |
Лужноземельні метали |
Валентні електрони |
1 |
2 - s1p1 |
2 - s1p1 |
Проявляють ступені окиснення |
+1 |
+2
|
+2 |
Взаємодія металів з водою |
Дуже активно за звичайних умов з утворенням лугу і Н2 |
Ве – не взаємодіє Мg – при нагріванні з утворенням Мg (ОН)2 і Н2 |
за звичайних умов з утворенням лугу і Н2 |
Оксиди та їх характер |
основний |
ВеО – амфотерний МgО - основний |
основний |
Гідроксиди та їх характер |
основний |
Ве (ОН)2 - амфотерний Мg (ОН)2 - основний |
основний |
Леткі водневі сполуки |
Не утворюються |
Не утворюються |
Не утворюються |
Проаналізуйте дану таблицю. Поясніть зміну властивостей хімічних елементів Ве, Мg, Са, Sr, Ва та їх сполук за положенням в періодичній системі Д.І. Менделєєва.
Запитання для самоконтролю і контролю знань
В чому полягають особливості будови атомів s-елементів?
Які ступені окиснення в сполуках проявляють s -елементи І та ІІ груп ПС? Чому?
У вигляді яких мінералів Ве, Mg, Са, Ва, Ra знаходяться в природі?
Порівняйте фізичні властивості даних металів.
Складіть рівняння хімічних реакцій, які підтверджують хімічні властивості берилію, магнію, кальцію, барію.
Поясніть характер оксидів, пероксидів та гідроксидів даних металів. Доведіть це за допомогою рівнянь хімічних реакцій.
Поясніть окисно-відновні властивості сполук даних металів. Доведіть це за допомогою рівнянь хімічних реакцій.
Як хімічним способом довести наявність амфотерних властивостей сполук берилію?
Як застосовуються дані метали та їх сполуки в промисловості? Які сплави з них виготовляють?

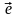 - s1
- s1