
ЛР 2
.docЛабораторна робота 2
Тема: Визначення молярної маси еквівалента металу методом витіснення водню
Мета: експериментально перевірити достовірність закону еквівалентів.
-
Теоретична частина
Еквівалентом хімічного елемента називають таку його кількість (), яка взаємодіє з одним молем атомів Гідрогену або заміщує один моль атомів Гідрогену в хімічних реакціях.
Визначається еквівалент хімічного елемента за формулою:
![]()
Наприклад:
Е(Н)= 1 моль
Е(О)= 1/2 моль (в оксидах);
Е(N)=
1/3
моль (в
![]() );
);
Е(Mg)=1/2 моль ;
E(Al)=1/3 моль;
Е(Fe)=1/2
моль
(в
![]() );
);
Е(Fe)=1/3
моль
(в
![]() );
);
Еквівалент не є сталою величиною.
Еквівалентом простої або складної речовини називають таку його кількість (), яка взаємодіє без залишку з одним еквівалентом Гідрогену або з одним еквівалентом будь-якої іншої речовини. Наприклад:
Е(Н2)=1/2 моль;
Е
1 моль ¼ моль
Е(N2)=1/6 моль; N2 + 3Н2 = 2NH3
1/6 моль 1 моль
Е(NH3)=1 моль; NH3 + Н+NH4+
1 моль 1 моль катіон амонія
Еквівалент оксидів визначається за формулою:
![]()
Наприклад:
Е(![]() )=
)=![]() моль;
моль;
Е(![]() )=
)=![]() моль;
моль;
Еквівалент солей визначається за формулою:
![]()
Наприклад:
Е(![]() )
=
)
=
![]() моль;
моль;
Е(![]() )
=
)
=
![]() моль;
моль;
Еквівалент кислот в хімічних реакціях залежить від кількості заміщених катіонів Гідрогену і визначається за формулою:
Е(НхК3)
=![]() моль;
моль;
Наприклад:
H3PO4
+
3NaOH
= Na3PO4
+
3H2O;
E(H3PO4)
=
![]() моль;
моль;
H3PO4
+
2NaOH
= Na2HPO4
+
2H2O;
E(H3PO4)
=
![]() моль;
моль;
H3PO4 + NaOH = NaH2PO4 + H2O; E(H3PO4) = 1 моль
Еквівалент основ в хімічних реакціях залежить від кількості заміщених аніонів гідроксильних груп і визначається за формулою:
Е(Е(ОН)у
)
=![]() моль;
моль;
Наприклад:
Сa(OH)2 + 2HCl = CaCl2 + 2H2O; E(Ca(OH)2) = 2 моль;
Сa(OH)2 + HCl = CaОНCl + H2O; E(Ca(OH)2) = 1 моль.
Еквівалентна маса - це молярна маса одного еквівалента хімічного елемента або речовини.
тЕ
= МЕ
(
![]() ); М-
молярна маса;
); М-
молярна маса;
Наприклад:
тЕ(Mg)=24![]() =12
=12
![]() ;
;
тЕ(Al2O3)=112![]() =37,3
=37,3
![]() ;
;
тЕ(H2SO4)=98
![]() =49
=49
![]() ;
;
тЕ(NaOH)=401=40![]() .
.
Також еквівалентна маса розраховується за формулою:
тЕ=![]() ,де
,де
m – маса речовини, nE – число еквівалентів речовини.
Еквівалентний об’єм - це молярний об’єм одного еквівалента газоподібної речовини.
VE=VmE ;
Vm- молярний об’єм газоподібної речовини за н.у.
Наприклад:
VE(Н2)=22,4![]() =11,2
=11,2
![]() ;
;
VE(О2)=22,4![]() =5,6
=5,6
![]()
![]() .
.
Також еквівалентний об’єм розраховується за формулою:
VE=![]() ,
де
,
де
V – об’єм газоподібної речовини, nE – число еквівалентів газоподібної речовини.
В хімічних реакціях хімічні речовини реагують у строго еквівалентних кількостях речовин. В цьому полягає закон еквівалентів:
Хімічні речовини взаємодіють між собою в строго еквівалентних відношеннях.
Наслідки закону:
-
Кількості реагуючих речовин в хімічних реакціях пропорційні їх еквівалентам:
![]() ;
;
-
 Маси
реагуючих речовин в хімічних реакціях
пропорційні їх еквівалентним масам:
Маси
реагуючих речовин в хімічних реакціях
пропорційні їх еквівалентним масам:
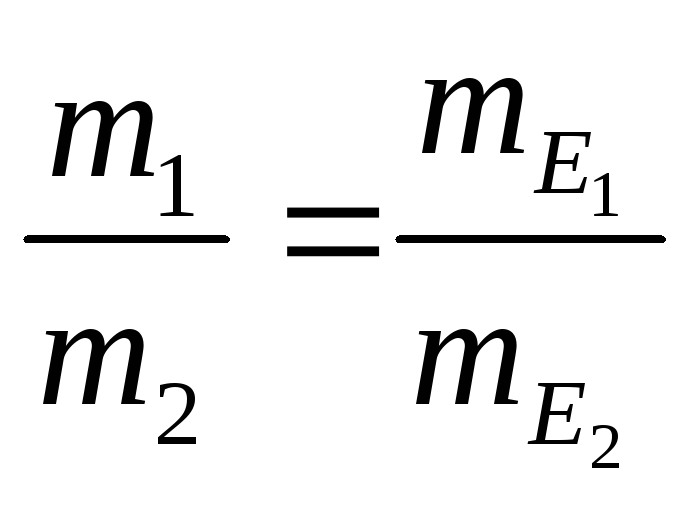 ;
;
-
Кількості еквівалентів реагуючих речовин в хімічних реакціях дорівнюють одна одній:
![]()
Запитання для самоконтролю
-
Що називається еквівалентом хімічного елемента простої або складної речовини? Як він визначається?
-
Що називається еквівалентною масою хімічного елемента або речовини та як вона визначається?
-
Що називається еквівалентним об’ємом газоподібної речовини та як він визначається?
-
Як формулюється закон еквівалентів та його наслідки?
-
Як застосовується закон еквівалентів в хімії?
Завдання для самоконтролю
Рівень А.
-
Визначте еквівалент та еквівалентну масу хімічних елементів та речовин: Mg, Al, Na, P2O5, KOH, Al2(SO4)3, HCl.
-
Визначте еквівалентний об’єм газоподібних речовин за н.у.: O2, NH3, N2.
-
Визначте еквівалентну масу Нітрогена в наступних сполуках:
а) N2O; б) NO; в) N2O3; г) NO2; д) N2O5.
Рівень В.
-
Сульфід метала містить 29,48% Сульфуру. Визначте еквівалентну масу метала, якщо еквівалентна маса Сульфуру дорівнює 16 г/моль.
-
При розчиненні в воді 1,6 г металу виділилось 0,896 л (н.у.) водню.
-
Знайти еквівалентну масу ртуті, якщо з 1 г її оксиду при нагріванні виділилося 51,7 мл кисню.
Рівень С.
-
Визначте еквівалент метала, якщо на відновлення 6,8 г його оксиду необхідно стільки водню, скільки його утворилось при розчинні в хлоридній кислоті 13 г цинку.
-
На відновлення 4,8 г метала використали 2,016 л водню (н.у.). при розчиненні в хлоридній кислоті метала, який утворився, виділилось 1,344 л водню (н.у.). Визначте невідомий метал.
-
На нейтралізацію 9 г кислоти іде 8 г натрій гідроксиду. Визначте еквівалентну масу кислоти.
-
Експериментальна частина
Метод ґрунтується на вимірюванні об’єму водню, який виділяється з кислоти при дії на неї металу.
Прилад, який використовується з цією метою, називається «сполучені сосуди». Складається із бюретки 1 для збирання водню і вирівнювального посуду 2 (бюретка або лійка), з’єднаних між собою гумовою трубкою. В бюретці рівень води повинен бути нижче нуля. Бюретку зверху закривають пробкою з газовідвідною трубкою, до якої приєднують пробірку 3, де протікатиме реакція між металом та кислотою. Об’єм водню, що виділиться в ході реакції, визначають за різницею рівнів води в бюретці до і після досліду. При цьому рівень води в посудинах повинен бути однаковим, щоб тиск газу в бюретці дорівнював атмосферному.
Хід роботи
Рівень А.
Визначення молярної маси еквівалента Магнію
На технологічних терезах з точністю до 0,01 г зважити шматочки магнію масою 2-3 г. В пробірку налити хлоридної кислоти (1/4 пробірки); тримаючи пробірки в нахиленому стані, помістити наважку металу (не опускаючи в кислоту) на стіну біля отвору пробірки і закрити пробірку пробкою з газовідвідною трубкою від бюретки. Перевірити прилад на герметичність. Для цього, не займаючи пробірки з бюреткою, перемістити вирівнювальний посуд разом з лапкою штативу таким чином, щоб рівень води в ньому став на 10-15 см вище, ніж в бюретці. Якщо різниця рівнів не змінюється, то прилад герметичний.
П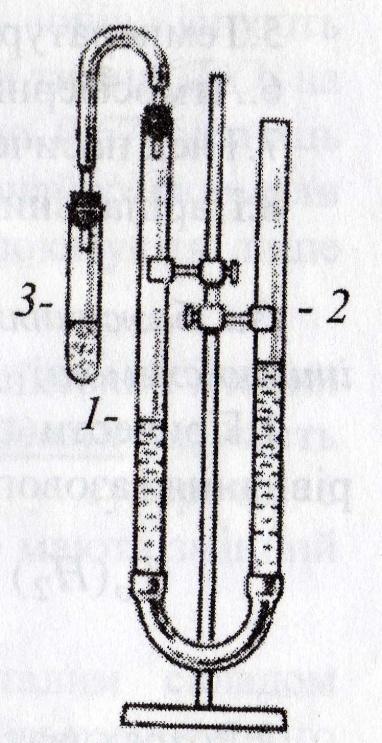 ривести
воду в посудинах до одного рівня і
відмітити рівень води в бюретці (а1,
в мл). Рівень води відмітити за нижнім
краєм меніску з точністю до 0,1 мл.
ривести
воду в посудинах до одного рівня і
відмітити рівень води в бюретці (а1,
в мл). Рівень води відмітити за нижнім
краєм меніску з точністю до 0,1 мл.
Струсити метал в кислоту. Спостерігати виділення водню і витискання води з бюретки.
Після закінчення реакції привести прилад до кімнатної температури, а воду в посудинах до одного рівня і відмітити рівень води в бюретці (а2, в мл). За різницею рівнів води розрахувати об’єм водню, що виділився (а2-а1, в мл).
Рівень В.
Визначення молярної маси еквівалента металу
Одержати наважку металу у лаборанта або викладача. Провести дослід, як описано в рівні А.
Запис результатів досліду для рівня А і Б
-
Номер металу - ;
-
Маса металу - г;
-
Рівень води в бюретці на початку досліду, а1- мл;
-
Рівень води в бюретці після досліду, а2- мл;
-
Об’єм водню, що виділився V(H2) = a2-a1= мл;
-
Температура, t0C- ;
-
Атмосферний тиск, р- ;
-
Тиск насиченої водяної пари, р(Н2О) - ;
-
Парціальний тиск водню, р(Н2) = р - р(Н2О) = .
Розрахунки
Для рівня А і В.
1. Привести об’єм водню до нормальних умов, використавши рівняння газового стану (об’єднаного газового закону Бойля Маріотта та Гей- Люссака):
![]()
2. Розрахувати молярну масу еквівалента металу, використовуючи закон еквівалентів:
nЕ(Н2) = nЕ(Ме);
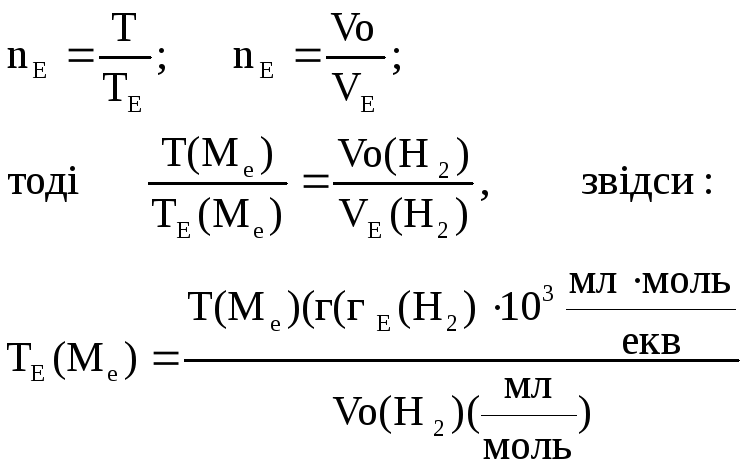
Для обчислення молярної маси металу визначитись з викладачем з еквівалентом металу.
3. Розрахувати молярну масу металу (експериментальну):
М(Ме)
=
![]() або М(Ме) = mЕ
n
або М(Ме) = mЕ
n![]() ;
;
де
п![]() -
кількість електрон-переходів в процесі
Ме
-
кількість електрон-переходів в процесі
Ме![]() Меп+
+
п
Меп+
+
п![]()
4. Розрахувати відносну похибку експерименту:
![]()
Рівень С
Визначення молярної маси еквівалента металу
Одержати наважку металу у лаборанта або викладача. Провести дослід, як описано в рівні А. Визначити молярну масу еквівалента металу, виконавши розрахунки за власною схемою.
