
- •Теоретична частина
- •Загальна характеристика d-елементів vііі групи сімейства Феруму
- •Властивості Феруму та його сполук
- •Властивості Кобальту та його сполук
- •Властивості нікелю та його сполук
- •Утворення і застосування металів сімейства заліза
- •2. Запитання для самоконтролю і контролю знань
- •3. Завдання для самоконтролю
- •4. Експериментальна частина
Лабораторна робота 16
Тема: Хімічні властивості d-елементів VІІІ групи сімейства Феруму періодичної системи Д.І. Менделєєва
Мета та основні завдання:
удосконалити знання студентів із структури, критеріїв періодичності періодичної системи Д.І. Менделєєва, особливостей будови атомів металів;
удосконалити знання студентів з фізичних та хімічних властивостей металів; способів утворення та застосування металів;
удосконалити уміння студентів складати молекулярні рівняння хімічних реакцій, рівняння окисно-відновних реакцій; іонні рівняння;
удосконалити уміння студентів в розв’язанні задач за формулами та рівняннями;
формувати у студентів уміння працювати в складі малих груп;
формувати уміння студентів давати визначення поняттям;
розвивати комунікативні уміння студентів;
розвивати системне мислення студентів;
розвивати професійні навички студентів в роботі з хімічними реактивами та хімічним обладнанням.
Прикладні задачі: розглянути особливості будови атомів d-елементів VІІІ групи сімейства Феруму ПС; фізичні та хімічні властивості простих і складних речовин, утворених d-елементами VІІІ групи сімейства Феруму ПС; способи утворення даних речовин; їх застосування.
Ключові поняття: d-електрон, d-елемент, метали, фізичні властивості металів, хімічні властивості металів, способи утворення металів, застосування металів.
Теоретична частина
Загальна характеристика d-елементів vііі групи сімейства Феруму

 До елементів
VІІІ групи сімейства
Феруму відносяться Ферум Fe,
Кобальт Co, Нікель Ni.
Дані елементи утворюють хімічні
зв’язки за рахунок орбіталей
зовнішнього і передзовнішнього
електронних рівнів. У своїх
сполуках елементи проявляють ступені
окиснення +2, +3. В найбільш стійких
сполуках Кобальт і Нікель проявляють
ступінь окиснення +2, а Ферум +3. У атома
Феруму, який має електронну формулу
3s23p63d64s2, валентні
електрони заповнюють енергетичні рівні
наступним чином:
До елементів
VІІІ групи сімейства
Феруму відносяться Ферум Fe,
Кобальт Co, Нікель Ni.
Дані елементи утворюють хімічні
зв’язки за рахунок орбіталей
зовнішнього і передзовнішнього
електронних рівнів. У своїх
сполуках елементи проявляють ступені
окиснення +2, +3. В найбільш стійких
сполуках Кобальт і Нікель проявляють
ступінь окиснення +2, а Ферум +3. У атома
Феруму, який має електронну формулу
3s23p63d64s2, валентні
електрони заповнюють енергетичні рівні
наступним чином:
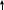
3d6 4s2 4р
При збудженні атома Феруму один із спарених 4s-електронів переходить на 4р-підрівень. В результаті цього у атома Феруму з’являється шість неспарених електронів. В цьому стані він може проявляти вищий ступінь окиснення +6.
Ферум – один з найбільш розповсюджених елементів в природі: вміст його в земній корі складає 5% (мас.). Кобальта і Нікелю в земній корі значно менше. Важливе значення мають мінерали Феруму: магнетит (магнітний залізняк) Fe3О4, гематит (червоний залізняк) Fe2О3, лімоніт (бурий залізняк
Fe2О3∙nН2О, сидерит (залізний шпат) FeСО3, пірит (залізний колчедан) FeS2.
Властивості Феруму та його сполук
Хімічно чисте залізо – сріблясто-білий пластичний метал. Він легко намагнічується і розмагнічується. Густина – 7870 кг/м3. При 15390С залізо плавиться, а при 27400С кипить. Воно має високу ковкість, електричну провідність, теплопровідність.
Залізо високої чистоти стійке на повітрі і в воді внаслідок утворення на поверхні суцільної плівки оксидів. Але звичайне залізо, яке містить різноманітні домішки, в вологій атмосфері швидко покривається іржею:
4Fe + 3О2 + 6Н2О = 4Fe(ОН)3.
В порошкоподібному стані залізо легко окислюється киснем повітря:
4Fe + 3О2 = 2Fe2О3; 3Fe + 2О2 = Fe3О4.
Воно легко взаємодіє з хлором, утворюючи FeCl2, FeCl3. При нагріванні залізо реагує з багатьма неметалами:
3Fe + С = Fe3С; 2Fe + N2 = 2FeN; Fe + S = FeS.
Залізо легко розчиняється в розбавлених хлоридній та сульфатній кислотах: Fe + 2НСl = FeСl2 + H2↑; Fe + Н2SО4 = FeSО4 + H2↑;
в концентрованій сульфатній кислоті – тільки при нагріванні:
2Fe + 6Н2SО4 = Fe2(SО4)3 + 3SО2 + 6H2О.
В концентрованій нітратній кислоті залізо пасивується, тому що покривається щільною плівкою нерозчинних оксидів.
Ферум (ІІ) оксид FeО – основний оксид, який являє собою кристали чорного кольору, не розчиняється у воді, але легко розчиняється в кислотах:
FeО + 2НСl = FeСl2 + H2О.
Солі Fe(ІІ) – сильні відновники: 2FeСl2 + Сl2 = 2FeСl3.
На повітрі в присутності води вони поступово окислюються до солей Fe(ІІІ):
4FeSО4 + О2 + 2H2О = 4Fe(ОН)SО4
ферум (ІІІ) гідроксосульфат
Якщо до розчину солі Fe(ІІ) додати розчин лугу, то випадає осад зеленого кольору ферум (ІІ) гідроксид:
FeСl2 + 2NаОН = Fe(ОН)2↓ + 2NаСl.
Осад швидко темніє, стає чорним, а пізніше бурим. Відтак, Fe(ОН)2 теж відновник: 4Fe(ОН)2 + О2 + 2H2О = 4Fe(ОН)3.
Ферум (ІІІ) оксид Fe2О3 – тверда порошкоподібна речовина червоно-бурого кольору. Оксид має слабко виражені амфотерні властивості. Він розчиняється в кислотах: Fe2О3 + 3Н2SО4 = Fe2(SО4)3 + 3H2О.
Солі Fe(ІІІ) виступають окисниками:
2FeСl3 + 2NаІ = 2FeСl2 + 2NаСl + І2;
2FeСl3 + Fe = 3FeСl2;
2FeСl3 + Н2S = 2FeСl2 + S + 2НСl.
Під дією води солі Fe(ІІІ) підлягають гідролізу, утворюючи основні солі: FeСl3 + Н2О ⇄ Fe(ОН)Сl2 + НСl.
Ферум проявляє помітну здатність до комплексоутворення. Із стійких комплексних сполук Феруму заслуговують на увагу жовта та червона кров’яні солі. Важливою властивістю цих солей є те, що вони виявляють катіони Феруму (ІІІ) та Феруму (ІІ) в якісних реакціях. Жовта кров’яна сіль К4[Fe(CN)6] - калій гексаціаноферат (ІІ) взаємодіє з катіонами Fe3+ в розчинах, утворюючи нерозчинну у воді комплексну сіль синього-зеленого кольору Fe4[Fe(CN)6]3, яка називається берлінською блакиттю:
4FeСl3 + 3К4[Fe(CN)6] = Fe4[Fe(CN)6]3↓ + 12KСl.
Червона кров’яна сіль К4[Fe(CN)6] - калій гексаціаноферат (ІІІ) взаємодіє з катіонами Fe2+ в розчинах, утворюючи малорозчинну у воді комплексну сіль яскраво-синього кольору – турнбленову синь:
3FeСl2 + 2К3[Fe(CN)6] = Fe3[Fe(CN)6]2↓ + 6KСl.
Другою якісною реакцією на катіон Fe3+ є реакція з калій тіоціонатом KSCN або амоній тіоціонатом NH4SCN. Утворюється комплексна сіль червоного кольору [Fe(SCN)3]:
FeСl3 + 3KSCN = [Fe(SCN)3] + 3КСl.
