
- •1. Теоретична частина
- •1.1. Загальні властивості металів
- •1.2. Хімічні властивості металів
- •1.3. Електрохімічні властивості металів
- •1.3. Сплави
- •1.4. Поширення у природі і одержання металів і сплавів
- •2. Запитання для самоконтролю та контролю знань
- •3. Приклади розв’язання задач для самостійної роботи
- •4. Завдання для самоконтролю
Модуль ІІ
Хімія елементів
Лабораторна робота 10
Семінар
Тема: Загальні та електрохімічні властивості металів
Мета та основні завдання:
удосконалити знання студентів з типів хімічного зв’язку, фізичних та хімічних властивостей речовин;
формувати знання студентів з електрохімічних властивостей речовин;
удосконалити уміння студентів складати рівняння окисно-відновних реакцій; іонні рівняння;
формувати у студентів уміння працювати з рядом стандартних електродних потенціалів;
удосконалити уміння студентів в розв’язанні задач за формулами;
формувати у студентів уміння працювати в складі малих груп;
формувати уміння студентів давати визначення поняттям;
розвивати комунікативні уміння студентів;
розвивати системне мислення студентів.
Прикладні задачі: дослідити особливості будови атомів металів, розташування металевих та перехідних хімічних елементів в ПС, металевої кристалічної гратки, металевого хімічного зв’язку, склад та властивості сплавів, фізичні та хімічні властивості металів, електрохімічні властивості металів, поширення металів у природі, способи добування металів, способи очистки металів та захисту від корозії.
Ключові поняття: вид кристалічної гратки, тип хімічного зв’язку, фізичні властивості речовин, хімічні властивості речовин, способи добування речовин, електродний потенціал, ряд стандартних електродних потенціалів, електроліз, гальванічний елемент.
1. Теоретична частина
1.1. Загальні властивості металів
Переважна кількість хімічних елементів періодичної системи Д.І. Менделєєва (понад 80%) утворює прості речовини метали. Це s-елементи І та ІІ груп (окрім Н і Не), р-елементи ІІІ групи (окрім В), ІV групи (Ge, Sn, Pb), V групи (Sb, Bi), VI групи (Ро), усі d- та f-елементи.
Поясніть, чому хімічні елементи, які утворюють прості речовини метали, займають саме це місце в періодичній системі Д.І. Менделєєва?
Загальною особливістю атомів металів є мала кількість електронів на зовнішніх електронних рівнях.
Метали характеризуються своєрідним типом хімічного зв’язку –металічним зв’язком. Зовнішні (валентні) електрони атомів металів утримуються значно слабкіше, ніж в атомах неметалів, утрачають зв'язок з окремими атомами, усуспільнюються й утримують позитивні іони в зближеному стані. Вільні, незв’язані з певними атомами електрони, здатні переміщуватись в усьому об’ємі тіла металу, утворюючи «електронний газ». Ненапрямлений і нелокалізований зв'язок атомів металу за твердому або рідкому стані металу за допомогою усуспільнених і делокалізованих валентних електронів називають металічним зв’язком.
Кристалічні гратки металів складаються з нейтральних атомів і позитивних іонів, між якими рухаються електрони - «електронний газ». Більшість металів кристалізується в одному з трьох типів кристалічної гратки: щільна гексагональна (Mg, Be, Zn), щільна кубічна гранецентрована (Al, Cu, Ag, Au, Ni), кубічна об’ємноцентрована (лужні метали, Cr,V, Pb, W).
Особливість металічного зв’язку та металічної кристалічної гратки обумовлюють фізичні властивості металів. Електрони, які заповнюють міжатомний простір, відбивають світові промені, що викликає непрозорість і характерний блиск металів. В найбільшій мірі ця властивість проявляється у срібла та індію, тому ці метали застосовують для виготовлення звичайних дзеркал, а також прожекторних дзеркал і рефлекторів. Метали мають блиск тільки в компактній масі, а в мілко дисперсному стані більшість з них чорного кольору і без блиску. Метали, які відбивають приблизно в однаковій степені всі світові промені видимого спектру, мають сріблясто-білий колір. Алюміній і магній зберігають металічний блиск навіть в порошкоподібному стані, вони здатні відбивати і радіохвилі, що використовується в радіолокації.
Електрони в процесі свого переміщення в кристалічній гратці метала переносять теплову енергію від нагрітих шарів до холодних. Тому мали проявляють властивість, яка називається теплопровідністю. Електрони, які хаотично рухаються в металі, під впливом прикладеної електричної напруги приймають направлений рух, тобто проводять електричний струм. Найкращими провідниками є срібло, мідь, алюміній. Електропровідність металів залежить від температури. З підвищенням температури зростає амплітуда коливань атомів і іонів кристалічної гратки металу, що ускладнює переміщення електронів, тому електропровідність знижується.
Дуже цінними властивостями металів є пластичність, пружність, міцність. Вони здатні під тиском змінювати форму, не руйнуючись. Це дозволяє викачувати їх в листи, витягувати в дріт. Міцність металів з підвищенням температури знижується, а пластичність збільшується. За мірою твердості метали значно відрізняються один від одного. Так, калій, натрій – м’які метали (їх можна різати ножем); хром за твердістю близький до алмазу. Температура плавлення і густина металів також змінюються в широких інтервалах. Самий легкоплавкий метал – ртуть (температура плавлення –38,870С); самий тугоплавкий – вольфрам ( температура плавлення 33700С). Густина літію – 590 кг/м3, а осмію – 22 480 кг/м3.
Метали відрізняються і за магнітними властивостями. Вони діляться на три групи:
феромагнітні метали – здатні намагнічуватись за дією слабких магнітних полів (залізо, кобальт, нікель, гадоліній);
парамагнітні метали – виявляють слабку здатність до намагнічування (алюміній, хром, титан і більша частина лантаноїдів);
діамагнітні властивості – метали не притягуються до магніту і навіть злегка відштовхуються від нього (вісмут, олово, мідь).
Метали характеризуються здатністю їхніх атомів легко віддавати зовнішні (валентні) електрони і перетворюватись на позитивні іони внаслідок низьких значень електронегативностей, які обумовлені невисокими енергіями іонізації атомів і невеликою (часто від’ємною) спорідненістю до електрона.
В хімічних процесах атоми металів можуть тільки віддавати електрони, виступаючи відновниками:
 .
.
В окисно-відновних реакціях метали-відновники взаємодіють з окисниками: простими речовинами неметалами (киснем, галогенами, сіркою, азотом, фосфором та іншими); складними речовинами: оксидами, кислотами, лугами, солями.
Які речовини утворюються при взаємодії металів з вище названими простими речовинами неметалами?
Відновлювальна здатність металів не однакова. Для реакцій в водних розчинах вона визначається положенням в електрохімічному ряді напруг металів:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H2,
Bi, Cu, Hg, Ag, Pd, Pt, Au.
При зануренні металевої пластинки в воду або у розчин, який має однойменні іони металу, на межі поділу метал-розчин встановлюється рівновага:
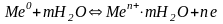 ,
,
виникає подвійний електричний шар. Пластинку метала, занурену в розчин електроліту, називають електродом, а різницю потенціалів – рівноважним електродним потенціалом металу.
Абсолютне значення електродного потенціалу вимірити експериментально або розрахувати теоретично неможливо, тому визначають його відносну величину в порівнянні із стандартним водневим електродом за стандартних умов (температура 250С, тиск 101,325 кПа) при концентрації розчину солі 1 моль/л і називають стандартним електродним потенціалом . Значення стандартних електродних потенціалів металів зведені в таблиці, яка називається «Ряд стандартних електродних потенціалів металів» (див. додаток 5). Стандартний електродний потенціал металу характеризує його властивості у розчинах:
1) зі збільшенням значення стандартного електродного потенціалу металу зменшуються відновлювальні властивості його атомів і збільшуються окислювальні властивості його катіонів;
2) метали, що мають негативне значення стандартного електродного потенціалу (стоять у ряді стандартних електродних потенціалів до Н2), здатні витісняти водень із розчинів кислот-неокисників (HCl, H2SO4 (розб.), H3PO4, CH3COOH);
3) метали з меншим значенням стандартного електродного потенціалу витісняють із розчинів солей метали із більшим його значенням.
Значення стандартного електродного потенціалу за нестандартних умов визначають за рівнянням Нернста:
ЕMen+/Ме
= Е0Меn+/Ме
+
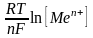 ,
де
,
де
Е0Меn+/Ме - значення стандартного електродного потенціалу метала;
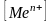 - концентрація іонів
металу;
- концентрація іонів
металу;
n – число електронів, що беруть участь в електродному процесі;
R – універсальна газова стала;
Т – абсолютна температура;
F – число Фарадея.
Підставивше в дане рівняння значення сталих R та F і перейшовши до десяткових логарифмів, одержимо:
ЕMen+/Ме
= Е0Меn+/Ме
+
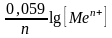 .
.
Концентрація іонів металу обчислюється за рівнянням:
= с
 n ∙
α, де
n ∙
α, де
с – молярна концентрація розчину;
n – число іонів металу, що утворюються з однієї молекули електроліту;
α – ступінь електролітичної дисоціації в частках одиниці.
