
- •1. Теоретична частина
- •1.1. Загальні властивості металів
- •1.2. Хімічні властивості металів
- •1.3. Електрохімічні властивості металів
- •1.3. Сплави
- •1.4. Поширення у природі і одержання металів і сплавів
- •2. Запитання для самоконтролю та контролю знань
- •3. Приклади розв’язання задач для самостійної роботи
- •4. Завдання для самоконтролю
1.2. Хімічні властивості металів
1. Взаємодія металів з водою.
Активні метали взаємодіють з водою за кімнатної температури, метали середньої активності – при нагріванні, малоактивні метали – не взаємодіють.
K, Ca, Na |
Mg, Al, Mn, Zn, Fe, Ti |
Cu, Hg, Ag, Pt, Au |
Витісняють водень ЕMen+/Ме < – 0,41 В
|
Не взаємодіють |
|
За кімнатної температури |
За високих температур |
|
2К + 2Н2О = 2КОН + Н2
Zn
+ H2O
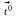 ZnO + Н2
.
ZnO + Н2
.
2. Взаємодія металів з оксидами інших металів.
Активні метали (Mg, Al, Na) взаємодіють з оксидами інших металів:
Fe2O3 + 2Al Al2O3 + 2Fe.
3. Взаємодія металів з розчинами солей інших металів.
Метали з меншим значенням стандартного електродного потенціалу витісняють із розчинів солей метали з його більшим значенням:
CuSO4 + Fe = Cu + FeSO4;
FeSO4 + Zn = ZnSO4 + Fe.
4. Взаємодія металів з кислотами.
Метали взаємодіють з кислотами з утворенням солей. Але в залежності від активності металу, природи та концентрації кислоти продукти відновлення кислоти можуть бути різними.
Метали, що мають негативне значення стандартного електродного потенціалу (стоять в ряду до Н2, окрім свинцю Рb) витісняють водень із кислот-неокисників: HCl, HBr, HI, HCN, H2SO4 (розб.), H3PO4, CH3COOH за загальною схемою:
Ме + кислота ⟶ сіль + Н2↑.
Наприклад, Zn + 2HCl = ZnCl2 + H2;
Mg + H2SO4(розб.) = MgSO4 + H2.
Свинець не взаємодіє з галогенводневими кислотами і H2SO4(розб.), тому що на поверхні металу утворються нерозчинні плівки: PbCl2, PbI2, PbBr2, PbSO4.
З концентрованою сульфатною кислотою метали взаємодіють за схемою:
Метали |
Продукти взаємодії з концентрованою H2SO4 |
Приклади |
K, Na, Mg |
H2S + сіль + H2O
|
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2О |
Al пасивує |
щільна оксидна плівка Al2O3 |
|
Mn, Zn |
S + сіль + H2O
|
3Мn + 4H2SO4 = 3МnSO4 + S + 4H2О |
Fe пасивує |
щільна оксидна плівка Fe2O3 |
|
Ni, Sn, Pb, Cu, Ag |
SО2 + сіль + H2O
|
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2О |
Pt, Au не взаємодіють |
|
|
При взаємодії металів з нітратною
кислотою HNO3
водень не відновлюється, а утворюються
продукти відновлення Нітрогену (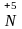 ):
):
 +
8
+
8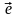 ⟶
⟶ (NH3, NH4NO3)
Активність металу
(NH3, NH4NO3)
Активність металу
+ 5
⟶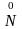 (N2)
знижується,
(N2)
знижується,
+ 4
⟶ (N2O) концентрація
(N2O) концентрація
+ 3
⟶ (NO) кислоти
(NO) кислоти
+ 1
⟶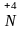 (NO2) збільшується
(NO2) збільшується
З нітратною кислотою метали взаємодіють за схемою:
Концентрована
Розведена
HNO3
на
Fe, Cr, Al,
Au, Pt, Ir,
Та
не діє
з
іншими
важкими
металами
з
лужними та
лужноземельними
металами
з лужнозе мельними
металами, а
також з
Zn та Fe
з
важкими металами
н а
NO2 N2O NH3 ( NH4NO3) NO
Наприклад: Ag + 2HNO3(конц.) = AgNO3 + NO2 + H2О;
3Ag + 4HNO3(розб.) = 3AgNO3 + NO + 2H2О;
4Zn + 10HNO3(розб.) = 4Zn(NO3)2 + N2O + 5H2О;
4Zn + 10HNO3(сильно розб.) = 4Zn(NO3)2 + NH4NO3 + 3H2О.
5. Взаємодія металів з лугами.
Деякі метали (Zn, Be, Al, Cr, Sn, Sb), що утворюють амфотерні гідроксиди, розчиняються в водних розчинах лугів, або взаємодіють з лугами при сплавленні. Наприклад:
- в розчинах ідуть реакції:
Zn + 2NaOH + 2H2О = Na2[Zn(OH)4] + H2↑;
2Al + 6NaOH + 6H2О = 2Na3[Al(OH)6] + 3H2↑;
- при сплавленні:
2NaOH + Zn = Na2ZnO2 + H2↑;
6NaOH + 2Al = 2Na3AlO3 + 3H2↑.
