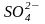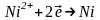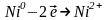- •1. Теоретична частина
- •1.1. Загальні властивості металів
- •1.2. Хімічні властивості металів
- •1.3. Електрохімічні властивості металів
- •1.3. Сплави
- •1.4. Поширення у природі і одержання металів і сплавів
- •2. Запитання для самоконтролю та контролю знань
- •3. Приклади розв’язання задач для самостійної роботи
- •4. Завдання для самоконтролю
1.3. Електрохімічні властивості металів
Спеціальні пристрої, в яких не електродах відбуваються мимоволі окисно-відновні процеси (∆G<˂0) і які створюють різницю потенціалів (електрорушійну силу ЕРС), а отже, можливість напрямленого переміщення електронів від одного електрода (негативного анода) до другого (позитивного катода), тобто електричний струм, називають хімічними джерелами струму. При цьому енергія окисно-відновної реакції перетворюється на електричну. Серед таких пристроїв виокремлюють гальванічні та паливні елементи, акумулятори.
Будь-який гальванічний елемент складається з двох електродів – металів, або інертних твердофазових матеріалів, занурених у розчин електролітів, які сполучаються між собою через пористу перетинку або трубку, заповнену електролітом, - електролітичний ключ. Електрод, на якому під час реакції відбувається напівпроцес окиснення відновника, називають анодом (негативний електрод), електрод, на якому здійснюється напівпроцес відновлення окисника, - катодом (позитивний електрод). У гальванічних елементах електродний потенціал катода завжди більший, ніж анода.
Прикладом може бути гальванічний мідно-цинковий елемент (елемент Якобі-Даніеля).
малюнок
Схема даного гальванічного елемента:
А(-) Zn | ZnSO4 || CuSO4|Cu (+)K
Двома вертикальними рисками позначено межу поділу розчинів обох солей. В цьому елементі цинковий електрод є анодом, а мідний – катодом:
ЕZn2+/Zn = - 0,76 B ˂ ЕCu2+/Cu = 0,34 B.
На аноді іде процес
окиснення:
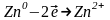 ;
;
На катоді іде процес відновлення:
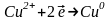 .
.
Сумарна реакція Zn + Cu2+ = Zn2+ + Cu є джерелом електричного струму.
Електрорушійну силу гальванічного елементу ЕРС визначають як різницю електродних потенціалів за формулою: ЕРС = Екатода – Еанода..
Корозія – це процес руйнування металу внаслідок хімічної або електрохімічної взаємодії його з навколишнім середовищем: повітрям, водою, газами, розчинами кислот, лугів і солей (лат. corrosion – роз’їдання). Розрізняють хімічну й електрохімічну корозії. В основі хімічної корозії лежать звичайні хімічні реакції утворення оксидів і солей у середовищах, що не проводять електричний струм (гази при високих температурах, нафтопродукти, мастила, продукти термічної деструкції полімерів).
Електрохімічна корозія виникає в системах, що проводять електричний струм у тих випадках, коли самовільно утворюються гальванічні елементи. На поверхні металу виникає велика кількість мікрогальванічних пар, і чим більша неоднорідність металу, тим вища швидкість його руйнування в електролітах.
Прикладом електрохімічної корозії є корозія чавуну і сталі у вологому середовищі: залізо іржавіє тому, що утворюються гальванічні елементи, в яких катодами є ділянки ферум карбіду Fe3C:
(-) Fe | Н2О, О2 | Fe3C (+).
На анодах окислюється залізо:
 .
.
На катодах відбувається відновлення:
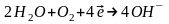 .
.
Внаслідок вторинних процесів:
Fe2+ + 2ОН−→ Fe(ОН)2;
4Fe(ОН)2 + О2 + 2Н2О = 4Fe(ОН)3;
Fe(ОН)3 = Н2О + FeО(ОН)
утворюється іржа – суміш нерозчинних продуктів – гідроксидів Fe(ОН)2, Fe(ОН)3 і оксигідроксидів заліза FeО(ОН).
Температура досить сильно впливає на швидкість корозії. Як правило, з підвищенням температури швидкість корозії збільшується. Велике значення у процесах корозії має склад і мікроструктура металу (чим метал однорідніший, тим корозійна стійкість вища).
Для зменшення корозії застосовують різні методи:
- обробляють навколишнє середовище з метою усунення речовин, які викликають корозію;
- замінюють повітря (О2) на гелій або інший інертний газ, чи просто створюють вакуум;
- додають різні інгібітори корозії (нітрати, карбонати, фосфати, хромати і біхромати, високомолекулярні сполуки, які адсорбуються на поверхні метала і сповільнюють корозію);
- створюють захисні плівки (оксидні, масляні, металічні або лакові);
- вводять у метал компоненти, що підвищують корозійну стійкість;
- застосовують протекторний або катодний захист.
При катодному захисті конструкція або деталь приєднуються до негативного полюса джерела електричного струму і стають катодом. В якості анода використовують шматки заліза. Відбувається відновлення окисника, а речовина анода окислюється.
Метод протекторів здійснюється приєднанням до металу, який треба захистити, великого шматка більш активного металу – протектора. В якості протектора при захисті стальних виробів зазвичай використовують цинк або сплави на основі магнію. Залізо менш активний метал, ніж цинк або магній. В результаті цього на залізі іде процес відновлення того окисника, який є в воді (як правило, розчинений у воді кисень), а більш активний метал окислюється. І протектори, і катодний захист застосовуються в середах, які добре проводять електричний струм, наприклад, у морській воді.
Електроліз – це сукупність окисно-відновних процесів, які відбуваються на електродах під час пропускання постійного електричного струму через розчини або розплави електролітів. В ході електролізу відбувається перетворення енергії електричного струму на енергію окисно-відновних реакцій на електродах.
Електрод, на якому відбувається відновлення, називається катодом; на якому відбувається окиснення – анодом. При електролізі катод заряджений негативно, а анод – позитивно, тобто розподіл знаків зарядів електродів протилежний тому, який відбувається при роботі гальванічного елементу. Причиною цього є те, що процеси, які відбуваються при електролізі, зворотні процесам роботи гальванічного елементу. При електролізі хімічна реакція здійснюється за рахунок анергії електричного струму, яка підводиться зовні, в той час як при роботі гальванічного елементу енергія самовільно протікаючої реакції в ньому перетворюється в електричну енергію.
Прикладом електролізу може бути електроліз розплаву магній хлориду, в якому відбувається процес електролітичної дисоціації:
MgCl2 ⟶ Mg2+ + 2Cl−.
При проходженні електричного струму через розплав MgCl2 катіони Mg2+ під дією електричного поля рухаються до негативного електрода - катоду. На ньому вони взаємодіють з електронами, які приходять по зовнішньому ланцюжку і відновлюються:
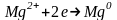 .
.
Аніони Cl− переміщуються до позитивного електрода - аноду і, віддаючи надлишкові електрони, окислюються:
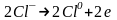 ;
2Сl0⟶
Cl2.
;
2Сl0⟶
Cl2.
Складаючи рівняння процесів, які протікають на електродах, отримаємо сумарне рівняння окисно-відновних реакцій:
Mg2+ + 2Cl− = Mg + Cl2, або MgCl2 = Mg + Cl2
При розгляданні електролізу водних розчинів треба враховувати, що окрім іонів електроліту в будь-якому водному розчині є продукти дисоціації молекул води: Н+ та ОН−. Таким чином, на катоді можуть відновлюватись як катіони електроліту, так і катіони Гідрогену Н+. Аналогічно на аноді можуть окислюватись як аніони електроліту, так і аніони гідроксильних груп ОН−.
Які саме електрохімічні процеси будуть протікати на електродах при електролізі, перш за все залежить від значень електродних потенціалів відповідних електрохімічних систем. Із декількох можливих процесів буде протікати той, на здійснення якого витрачається менша кількість енергії. Це означає, що на катоді буде відновлюватись насамперед окисник, якому відповідає найбільше значення електродного потенціалу, а на аноді буде окислюватись відновник з найменшим значенням електродного потенціалу. На хід протікання процесу електролізу впливає і матеріал, з якого зроблено електрод. Деякі випадки процесу електролізу за різних умов розглянемо в таблиці.
Таблиця 10.1 Електроліз в водних розчинах солей за різних умов
Умови проходження електролізу |
На катоді (-) |
На аноді (+) |
Приклади |
Сіль утворена Ме ЕMen+/Ме >> – 0,41 В в ряді СЕП після Н2 (Sn, Cu, Ag, Pt, Au),
безоксигеновою кислотою (HCl, HBr, HI) рН = 7
|
Відновлюється Ме
|
На інертному аноді окислюється аніон Cl−, Br−, I−
|
СuCl2→Cu2+ + 2Cl−
K (-)
A (+)
СuCl2 → Cu + Cl2
|
Сіль утворена Ме ЕMen+/Ме ˂˂ – 0,41 В в ряді СЕП до Ті (K, Na, Ca, Mg, Al),
оксигеновмісною кислотою (H2SO4,HNO3) рН = 7 |
Не відновлюється Ме, відновлюється Н2О
|
На інертному аноді окислюється Н2О
|
KNO3→K+
+
K (-)
A (+)
2KNO3 + 4Н2О → 2H2+O2+ 2HNO3 + 2KOH |
Сіль утворена Ме
ЕMen+/Ме
в ряді СЕП проміжне місце (Zn, Cr, Fe, Cd, Ni)
оксигеновмісною кислотою (H2SO4,HNO3) рН = 7
|
Як відновлення Ме , так і відновлення Н2О |
На нікелевому аноді |
NiSO4→Ni2+
+
ENi2+/Ni >> – 0,41 В
K
(-)
A
(+)
Електрохімічне очищення нікелю – електролітичне рафінування |
Основні закономірності явища електролізу вперше вивчив і виклав у вигляді законів електролізу англійський учений Фарадей.
Перший закон Фарадея. При електролізі маса речовини, що виділяється на електродах прямо-пропорційна кількості електричного струму, що проходить крізь розчин або розплав електроліту.
m= k ∙ Q
Якщо Q = 1Кл, то m= k, тобто k показує, яка маса речовини виділяється на електроді при проходженні 1 Кл електричного струму крізь електроліт, і називається електрохімічним еквівалентом.
Відомо, що Q = I ∙ τ, отже m= k ∙ I ∙ τ, де
І – сила електричного струму, А;
τ – тривалість електролізу, с.
Другий закон Фарадея. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
Для того щоб виділити на електроді один еквівалент будь-якої речовини, треба затратити 96500 Кл (точніше 96487 Кл) електричного струму. Ця кількість електричного струму називається числом Фарадея і позначається F. Оскільки k = me(X)/F, то отримаємо об’єднаний вираз першого і другого законів Фарадея:
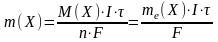 ,
де
,
де
m(X) – маса речовини, що виділилась на електроді, г;
n – кількість електронів, що беруть участь в електродному процесі (для процесів виділення металів згідно з рівнянням , n – дорівнює зарядові іона Меn+);
me(X) – молярна маса еквівалента речовини, г/моль;
І – сила струму, А;
τ – час проходження електролізу, с.

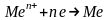
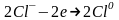
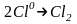

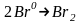
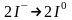
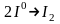
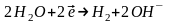
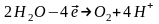


 – 0,41 В
– 0,41 В