
- •1. Теоретична частина
- •1.1. Загальні властивості металів
- •1.2. Хімічні властивості металів
- •1.3. Електрохімічні властивості металів
- •1.3. Сплави
- •1.4. Поширення у природі і одержання металів і сплавів
- •2. Запитання для самоконтролю та контролю знань
- •3. Приклади розв’язання задач для самостійної роботи
- •4. Завдання для самоконтролю
1.3. Сплави
У розплавлених металах можуть розчинятись інші метали, складні речовини та неметали. Під час охолодження таких розчинів утворюються сплави. Сплави, як і метали, у твердому стані мають кристалічну будову.
Під час кристалізації деяких сплавів утворюються хімічні сполуки. Такі сплави утворюють метали, які мають різну природу і помітно відрізняються за електронегативністю (наприклад, Mg і Sb, Mg і Pb). Хімічні сполуки металів також називають інтерметалічними сполуками. Вони мають зазвичай складну структуру, яка відрізняється від структур вихідних матеріалів. Властивості цих сполук також значно відрізняються від властивостей вихідних матеріалів. Так, криштали інтерметалічних сподук майже завжди ламкі, характеризуються низькими значеннями електро- та теплопровідності. Інтерметалічні сполуки відрізняються також високими теплотами утворення та хімічною стійкістю.
Кристали інших сплавів складаються з атомів вихідних металів, які хімічно не зв’язані один з одним. Вони називаються твердими розчинами з необмеженою розчинністю. Утворенню таких сплавів сприяє схожість хімічних властивостей металів, їх атомних радіусів і типів кристалічної структури. Наприклад, тверді розчини з необмеженою розчинністю утворюють золото і срібло. Температура, за якою відбувається затвердіння такого сплаву називають евтектичною точкою. Сплав, який являє собою механічну суміш кришталів двох металів певного складу, називають евтектичним, або евтектикою. Прикладами сплавів, які утворюють евтектику, є сплав олова і свинцю, свинцю з сурмою, кадмію з вісмутом. Евтектичний склад сплаву свинцю з сурмою: 13% Sb і 87% Pb, його температура плавлення 2460С, в той час як температура плавлення сурми 6300С, а свинцю – 3270С. Тому цей сплав застосовують в якості припою.
У світі для потреб техніки виробляється 75 металів і близько 1500 різних сплавів. Наприклад, чавун – це залізовуглецевий сплав, у якому масова частка вуглецю понад 2,14%. Сталь – залізовуглецевий сплав з масовою часткою вуглецю меншою за 2,14%. Дюралюміній містить 95% Al, 4% Cu; 0,5% Mg і 0,5% Mn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість складових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавлення утворюються хімічні сполуки металів. Високою твердістю характеризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких вони виготовлені.
1.4. Поширення у природі і одержання металів і сплавів
У природі більшість металів знаходиться в окисненому стані у вигляді оксидів, сульфідів, сульфатів, карбонатів, хлоридів, фосфатів та нітратів, які утворюють гірські породи (руди). Руда – природне мінеральне утворення, яке містить метали в таких сполуках і концентраціях, з яких виділення чистих металів технічно можливе і економічно доцільне.
У вільному стані в земній корі трапляються лише метали, які в ряду стандартних електродних потенціалів знаходяться праворуч від Гідрогену – Cu, Hg, Ag, Au, Pt.
Суть усіх методів добування металів зводиться до загального хімічного процесу відновлення їх з окисненого стану сполук металів:
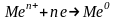 .
.
За типом вибраного відновника для реакції відновлення металу з його сполук металургійні процеси класифікують за методами, назви яких відображають назви відновників та специфічні умови процесів.
Розрізнюють два принципи реалізації металургійних процесів залежно від форм природних сполук (руд), в яких метал існує в природі.
1. Металургія більшості тих металів, які існують у природі у формі певних хімічних сполук у складі руд. У цьому випадку технологія зводиться до відновлення цих металів із їх окиснених форм.
2. Металургія деяких благородних і близьких до них за властивостями металів, які у природі існують у вільному, як правило, розсіяному у рудах стані. Тому такі руди попередньо збагачують.
Пірокарбометалургія – відновлення металів за допомогою газуватих відновників, таких як СО чи Н2, або за наявності твердого вуглецю (коксу). Відновлення оксидів металів (руд) цими відновниками відбувається за умови високих температур – пірометалургія.
Реакції відновлення вуглецем (коксом) і похідним від Карбону оксидом СО супроводжуються процесами утворення карбідів і тому в деяких випадках не можуть застосовуватися, наприклад, під час отримання вольфраму.
Ме + 2СО ⇄ МеС + СО2; Ме + С ⇄ МеС.
Тому для добування металів, чистих від вуглецю, в якості відновника використовують водень:
WО3 + 3Н2 ⇄ W + 3Н2О; Н2О + С ⇄ Н2 + СО.
Наприклад, у доменному процесі виплавлення чавунів (сплавів заліза з вуглецем і ферум карбідом, які містять понад 2% Карбону) відбуваються такі реакції:
С(кокс) + О2 → СО2↑; СО2 + С(кокс) ⇄ 2СО;
3Fe2O3 + CO →2Fe3O4 + СО2↑; Fe3O4 + CO →3FeO + СО2↑;
FeO + СО → Fe + СО2↑; FeO + С → Fe + СО↑;
3Fe + 2СO → Fe3С + СО2↑.
Ферум карбід Fe3С, що утворюється, переходить у розчин заліза. У домену піч додають флюс (СаСО3 і SiO2) у певних співвідношеннях. Флюс, перетворюючись на шлак, дає змогу виділяти з металу сірку S і частково фосфор Р, які є отрутами для сплавів заліза:
СаО + FeS + С ⇄ СаS↓ + Fe + СО↑.
Чавун розливають у виливниці або відразу в рідкому стані відправляють для переробки на сталь. Ливарний чавун із вмістом вуглецю до 3% використовують для виливання деталей машин, конструкцій, станин тощо. Переробний чавун використовують для виплавляння сталі, оскільки він містить до 6% вуглецю і більше допустимого вмісту Мангану та Силіцію.
Із чавуну виплавляють сталь трьох видів:
конвертерну – у конвертерах зі збагаченням і кисневим дуттям;
мартенівську – у печах Сіменс-Мартена з регенерацією теплоти вихідними газами;
електросталь – у електродугових, індукційних чи високочастотних печах (виробництво високолегованих сталей з особливими властивостями). Суть сталеплавильного процесу полягає в окисненні домішок у чавуні та зниженні вмісту вуглецю:
Si + O2 → SiO2; 2Mn + O2 →2MnO2;
2CaO + 4Fe3P + 5O2 → 2Ca(PO3)2 + 12Fe.
Продукти окиснення відводяться в шлак, який, маючи основні властивості (за рахунок СаО), додатково зв’язує Сульфур:
FeS + СаО → FeО + СаS↓.
Окиснення ферум карбіду відбувається за реакцією:
2Fe3С + О2 → 6Fe + 2СО↑.
Виділення СО називають процесом «кипіння» сталі. Після видалення домішок сталь звільняють від надлишку Оксигену – розкисляють додаванням до неї феросплавів (феросиліцію, феромангану, іноді феротитану).
У процесі виплавляння конверторної сталі її продувають інертними газами та обробляють синтетичними шлаками для підвищення якості. Підвищують якість сталей також упровадженням вакуумного, електрошлакового, плазмового і електронно-променевого переплавляння металу.
Інші метали, наприклад, Кобальт і Нікол спочатку переводять із сульфідів та арсенідів їхніх руд в оксиди і потім відновлюють цим способом. Завершальний етап отримання та очищення кобальту та нікелю здійснюють електролізом, оскільки ці метали в техніці використовують за умови їх високої чистоти, яка досягається електролітичним рафінуванням (див. табл. 10.1).
Металотермія – відновлення металів із їхніх сполук більш активними металами-відновниками, наприклад, алюмінієм – алюмінотермія, натрієм – натрієтермія, магнієм – магнієтермія тощо.
Кальцієм відновлюють La, Ge, Pr, Nb із їхніх хлоридів; Th, V, Y, Sc, Gd, Tb, Dy, Ho, Er, Tu, Lu – із фторидів. Магнієм відновлюють із оксидів U, V, B, із хлоридів – Ti, Zr, Th, Ta.
TiCl4 + 2Mg ⟶ 2MgCl2 + Ti.
За допомогою натрієтермії добувають ті метали, які можна хімічною переробкою перевести з руд у форму комплексних фторидів типу K2[NbF7] у розплаві, наприклад:
K2[NbF7] + Na ⟶ 5NaF + 2KF + Nb.
Гідрометалургія – видобування металів із сировини з використанням реагентів (H2SO4, KCN та інших) у вигляді сполук, розчинних у воді, з подальшою переробкою цих розчинів для виділення металів у вільному стані. Сировиною є руди, рудні чи хімічні концентрати (продукти механічного збагачення чи хімічної переробки руд), відходи інших виробництв. Гідрометалургією отримують кольорові метали – Al, Cu, Ni, Co, Zn та інші; рідкісні – Be, Ti, Zr, Hf, Nb, Ta, Mo, W та інші; благородні – Ag, Au, Pt та платинові метали.
Так, при переробці розбавленою сульфатною кислотою руди, яка містить CuO, мідь переходить в розчин у вигляді сульфату:
CuO + H2SO4 = CuSO4 + H2О.
Тоді мідь видобувають із розчину електролізом, чи витісняють із сульфату залізом:
CuSO4 + Fe = Cu + FeSO4.
Електроліз – спосіб добування металів, коли окисно-відновні процеси відбуваються на електродах під час пропускання електричного струму через розчини або розплави електролітів. Електроліз проводять у водних розчинах і в розплавах солей чи оксидів за високої температури. Загальні принципи і приклади електролізу подано в розд. 1.3. Електролізом можна виділити метал будь-якої активності, але тільки із сполук іонного типу, оскільки в ковалентних полярних сполуках електроліз не відбувається (ТіСl4, ZrСl4 тощо). За допомогою електролізу розплавів оксидів чи солей добувають лужні та лужноземельні метали, алюміній та інші.
Однією із найважливіших сучасних вимог науково-технічного прогресу у виробництві конструкційних матеріалів для машино- і приладодобування є чистота матеріалів, причому вимоги до якості постійно зростають. Метали високої чистоти мають кращі показники фізико-хімічних і механічних властивостей і тому потреба в них постійно зростає. Способи очищення металів умовно поділяють на хімічні та фізико-хімічні. Ступінь очищення металів і сплавів визначають за кількістю небажаних домішок (сірки, фосфору, кисню, водню, азоту, вуглецю тощо).
Хімічні способи очищення є універсальними. Велика кількість хімічних сполук дає змогу підібрати такі реагенти, які по-різному взаємодіють з основними та домішковими компонентами. Такі специфічні реакції сприяють переведенню одного з компонентів в осад або в газуватий стан, тобто створюють передумови для їх розділення. Важливою передумовою очищення металів є також попереднє подрібнення чорнових (забруднених) металів.
