
Лабораторна робота 14
Тема: Хімічні властивості d-елементів VІ групи періодичної системи Д.І. Менделєєва
Мета та основні завдання:
удосконалити знання студентів із структури, критеріїв періодичності періодичної системи Д.І. Менделєєва, особливостей будови атомів металів;
удосконалити знання студентів з фізичних та хімічних властивостей металів; способів утворення та застосування металів;
удосконалити уміння студентів складати молекулярні рівняння хімічних реакцій, рівняння окисно-відновних реакцій; іонні рівняння;
удосконалити уміння студентів в розв’язанні задач за формулами та рівняннями;
формувати у студентів уміння працювати в складі малих груп;
формувати уміння студентів давати визначення поняттям;
розвивати комунікативні уміння студентів;
розвивати системне мислення студентів;
розвивати професійні навички студентів в роботі з хімічними реактивами та хімічним обладнанням.
Прикладні задачі: розглянути особливості будови атомів d-елементів VІ групи ПС; фізичні та хімічні властивості простих і складних речовин, утворених d-елементами VІ групи ПС; способи утворення даних речовин; їх застосування.
Ключові поняття: d-електрон, d-елемент, метали, фізичні властивості металів, хімічні властивості металів, способи утворення металів, застосування металів.
Теоретична частина
Хімічні елементи, на електронних оболонках яких заповнюється електронами d-підрівень передзовнішнього енергетичного рівня, називаються d-елементами. D-елементи знаходяться в побічних підгрупах всіх восьми груп періодичної системи. D-елементи утворюють прості речовини метали.
1.1. Загальна характеристика d-елементів vі групи
В побічну підгрупу VІ групи входять хімічні елементи Хром Cr, Молібден Mo, Вольфрам W. Маючи на зовнішньому енергетичному рівні один (24Cr 3s23p63d54s1 і 42Mo 4s24p64d55s1) або два (74W 5s25p65d46s2) електрона (всього шість валентних електронів), дані елементи, на відміну від елементів головної підгрупи VІ групи, проявляють металічні властивості.
В сполуках елементи підгрупи Хрома проявляють позитивні ступені окиснення: Cr – 2,3,(4),6; Мо, W – 4,6.
Хром, молібден і вольфрам – сірувато-білі блискучі метали. На властивості цих металів значно впливають домішки. Так, чистий хром недостатньо твердий, а технічний забруднений хром - самий твердий із всіх металів. Чисті молібден і вольфрам значно м’якіші, але навіть незначні домішки в них збільшують їх твердість і крихкість. Всі метали підгрупи Хрома – тугоплавкі. Вольфрам – самий тугоплавкий з усіх досліджених металів (tпл = 34100С).
З водою хром, молібден і вольфрам реагують тільки при сильному нагріванні:
2Cr + 6Н2О = 2Cr(ОН)3 + 3Н2↑.
Взаємодії даних металів з водою заважає поверхнева оксидна плівка. За звичайних умов вони реагують тільки з фтором. Для взаємодії з іншими неметалами необхідне іноді значне нагрівання. Наприклад, хром горить в кисні тільки при температурі 20000С і вище, а молібден і вольфрам реагують з азотом при 15000С. При прожарюванні цих металів на повітрі хром окислюється до Cr2О3, а молібден і вольфрам – до МоО3 і WО3.
В порошкоподібному стані хром, молібден і вольфрам за умови нагрівання взаємодіють з хлором, утворюючи відповідні хлориди і проявляючи ступінь окиснення +3.
Заслуговує уваги відношення даних металів до дії кислот та луг. Розглянемо це в таблиці 14.1.
Таблиця 14.1. Взаємодія хрому, молібдену і вольфраму з кислотами та лугами
Метали |
HCl |
H2SO4 |
HNO3 |
«царська водка» HCl+HNO3 |
«диявольська суміш» НF+HNO3 |
NаОН |
Cr |
взаємодіє |
взаємодіє |
пасивує |
пасивує |
пасивує |
не взаємодіє |
Мо |
не взаємодіє |
не взаємодіє |
взаємодіє |
взаємодіє |
взаємодіє |
взаємодіє при нагріванні |
W |
не взаємодіє |
не взаємодіє |
не взаємодіє |
не взаємодіє |
взаємодіє |
взаємодіє за наявності О2, окисників NаNO3,KClO3
|
Наприклад: 2W + 4КОН + 3O2 = 2К2WО4 + 2H2O.
Самостійно складіть рівняння хімічних реакцій взаємодії даних металів з кислотами.
1.2. Сполуки хрому
Із всіх відомих сполук хрому практично приходиться зустрічатись тільки з тими, в яких він проявляє ступінь окиснення +3, +6. Це оксиди Cr2О3, CrО3 та їх похідні сполуки. Хром (ІІІ) оксид – тверда тугоплавка речовина темно-зеленого кольору, не розчинна ні у воді, ні в кислотах. Йому відповідає хром (ІІІ) гідроксид Cr(ОH)3 – речовина сіро-зеленого кольору, малорозчинна у воді. ЇЇ утворюють при дії луг на солі хрому (ІІІ):
Cr2(SO4)3 + 6NaOH = 2Cr(ОH)3↓ + 3Na2SO4.
Хром (ІІІ) гідроксид має амфотерні властивості. Він взаємодіє з кислотами:
Cr(ОH)3 + 3HCl = CrCl3 + 3H2O,
а з лугами дає хроміти (солі хромитної кислоти):
Cr(ОH)3 + NaOH = NaCrО2 + 2H2O (при сплавленні);
Cr(ОH)3 + 3NaOH = Na3[Cr(ОH)6] (в розчині).
Хром (VІ) оксид – кристалічна речовина темно-червоного кольору, легкорозчинна у воді з утворенням хромових кислот. Хром (VІ) оксид – сильний окисник. Якщо, наприклад, сухий CrО3 змочити етиловим спиртом, то спирт окислюється настільки енергійно, що відбувається самоспалах, а CrО3 відновлюється до Cr2О3. Хром (VІ) оксиду відповідає дві кислоти: хроматна Н2CrО4 і дихроматна (біхроматна) Н2Cr2О7. Вони існують тільки в водних розчинах і утворюють відповідно солі хромати і дихромати (біхромати).
Калій дихромат називають хромпіком.
Хромати в кристалічному стані і в водних
розчинах мають жовте забарвлення, яке
обумовлюється наявністю хромат-іона
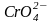 ;
дихромати – помаранчево-червоне
забарвлення, характерне для іонів
;
дихромати – помаранчево-червоне
забарвлення, характерне для іонів

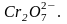
Хромат-іони стійкі в нейтральному та лужному середовищі. В кислому середовищі відбувається їх перетворення в дихромат-іони:
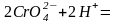
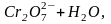
в результаті чого розчин забарвлюється в помаранчевий колір. Під дією лугу дихромат-іони перетворюються в хромат-іони:
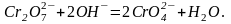
Отже, в кислому середовищі існують тільки дихромати, а в лужному – тільки хромати:
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O;
K2Cr2O7 + 2KOH = 2K2CrO4 + H2O.
Найважливішою властивістю хроматів і дихроматів є їх окислювальна здатність. Поясніть, чому! В кислому середовищі (рН < 7) Cr+6 відновлюється до Cr+3(див. табл. 5.2. «Класифікація речовин на окисники та відновники»). Наприклад: K2Cr2O7 + H2SO4 + К2SO3 → Cr2(SO4)3 + K2SO4 + H2O;
K2CrO4 + H2SO4 + H2S → Cr2(SO4)3 + S + K2SO4 + H2O.
В лужному ж середовищі Cr+3 окислюється до Cr+6 (див. табл. 5.2. «Класифікація речовин на окисники та відновники»). Наприклад:
NaCrO4 + NaОН + Вr2 → Na2CrO4 + NaВr + H2O.
Розставте коефіцієнти в даних рівняннях методом електронного балансу.
