
Лабораторна робота 3
Тема: Окисно-відновні реакції
Мета: дослідити проходження окисно-відновних процесів в розчинах, визначити речовини окисники та відновники.
Теоретична частина
Окисно-відновними називаються хімічні реакції, які проходять із зміною ступеня окиснення атомів. Ступінь окиснення - формальний заряд атома, який визначається за умовою того, що зв'язок між частинами йонний.
В молекулі простої речовини водню (Н2) зв'язок між атомами (Н-Н) ковалентний неполярний, відтягування спільної електронної пари до атомів не відбувається (Н:Н). Ступінь окиснення атомів Гідрогену в молекулі водню дорівнює 0.
Це
позначається:
![]() .
.
В молекулі складної речовини хлороводню (HCl) зв'язок між атомами (H-Cl) ковалентний полярний. Відбувається відтягування спільної електронної пари від атома Гідрогену до більш електронегативного атома Хлору.

![]() За
умовою того, що відбувається утворення
йонів Гідрогену та Хлору визначаємо
ступені окиснення атомів:
За
умовою того, що відбувається утворення
йонів Гідрогену та Хлору визначаємо
ступені окиснення атомів:
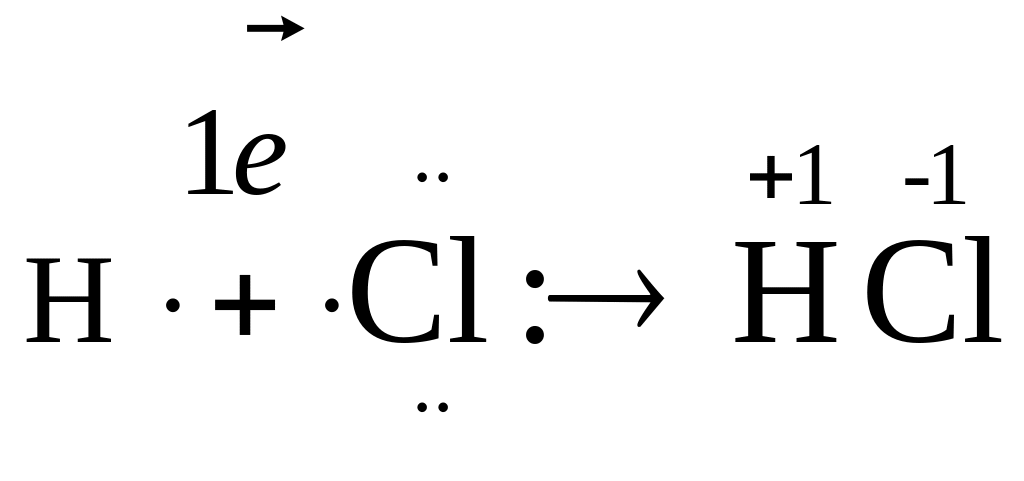

Ступінь окиснення атома позначається над знаком хімічного елемента. В кристалічній гратці сполуки натрій хлору (NaCl) зв'язок йонний, який утворюється при реальному переході електрона від атома Натрію до значно більш електронегативного атома Хлору:
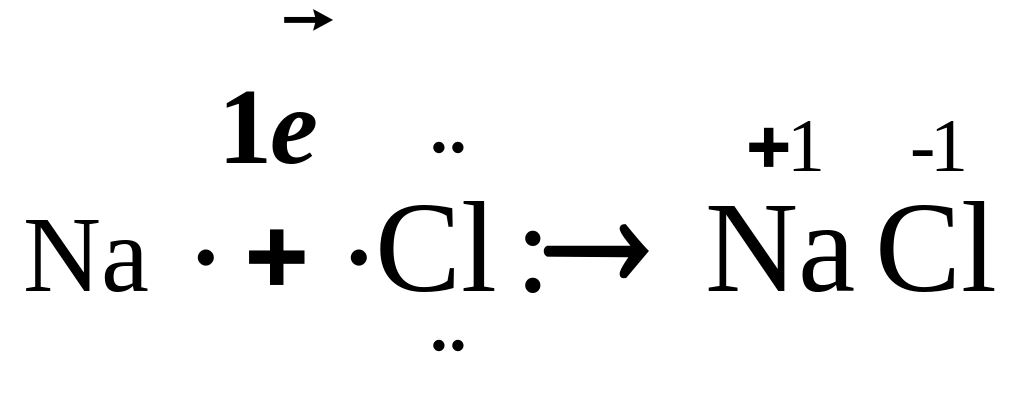
Утворюються частинки - йони, які мають реальний заряд йону:
![]()
![]()
Крім понять «ступінь окиснення атома» або «реальний заряд йона», які не можна ототожнювати, існує поняття «валентність», яке часто ототожнюють з поняттям «ступінь окиснення».
Валентність - це здатність атома утворювати певну кількість ковалентних зв’язків. Наприклад, в молекулах речовин СО2, СН4, НСОН, СН3ОН, НСООН, Н2С2О4 атом Карбону утворює чотири зв’язки, тобто валентність атома Карбону дорівнює IV:

а ступінь окиснення атому Карбону в молекулі кожної сполуки різна:
![]()
![]()
![]()
![]()
![]()
При розрахунках ступеня окиснення необхідно виходити з наступних положень:
В простих речовинах ступінь окиснення атомів завжди дорівнює нулю.
Атом Гідрогену у всіх сполуках має ступінь окиснення +1, крім сполук з металами - гідридів, де його ступінь окиснення дорівнює -1
(![]()
![]() )
)
Атом Флуору в усіх сполуках має ступінь окиснення -1, тому що атом Флуору найбільш електронегативний атом.
Атом Оксигену в усіх сполуках має ступінь окиснення -2 за виключенням оксиген фториду ОF2, де ступінь окиснення Оксигену +2, а також пероксидів, де ступінь окиснення Оксигену -1 (
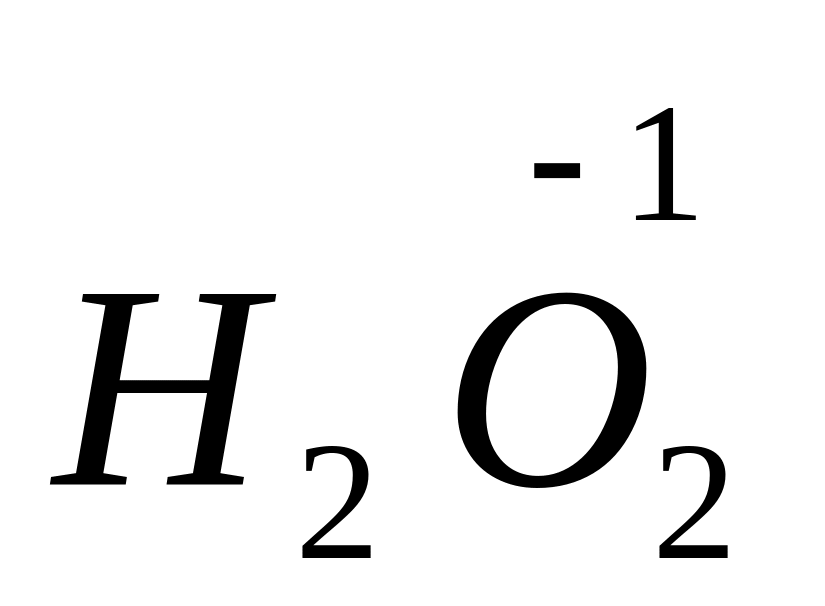 ;
; ).
).Атоми всіх s-елементів І групи періодичної системи
Д. І. Менделєєва мають ступінь окиснення в усіх сполуках +1 (крім Гідрогену), атоми s-елементів ІІ групи - завжди +2, атоми d- та f-елементів можуть мати різні ступені окиснення, але завжди позитивні.
Атом Алюмінію в усіх сполуках має ступінь окиснення +3.
Сума позитивних зарядів атомів в молекулі повинна дорівнювати сумі негативних зарядів - молекула електронейтральна частинка.
Розглянемо приклади розрахунків ступенів окиснення атомів в молекулах складних речовин:
В молекулі нітратної кислоти HNO3 ступінь окиснення атома Нітрогену розраховується так: ступінь окиснення атома Оксигену -2, атомів Оксигену три: (-2) 3 = 6, тобто сумарний негативний заряд -6; звідки сумарний позитивний заряд дорівнює +6. У атома Гідрогену ступінь окиснення +1, тому у атома Нітрогену повинен бути +5 -
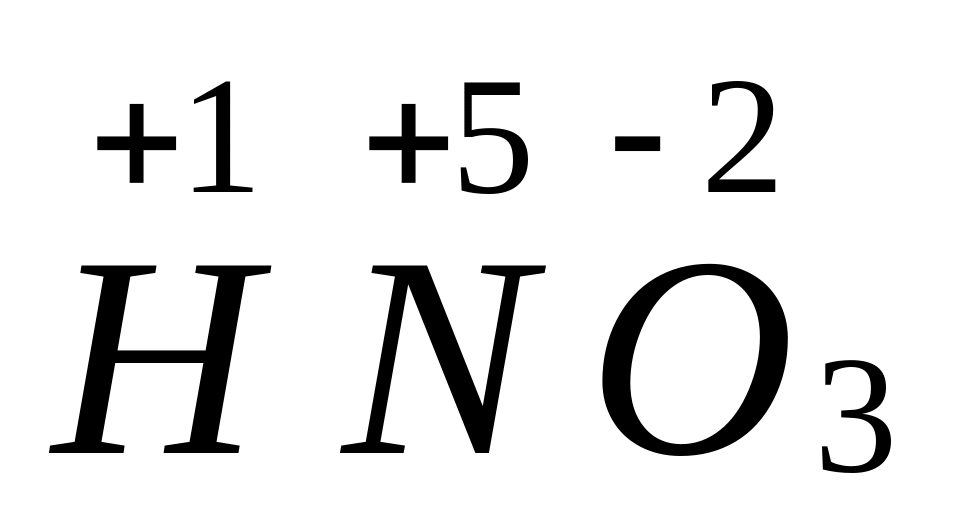 .
.
б)
Умовно в молекулі солі
![]() -
у атома Калію ступінь окиснення +1, у
атома Оксигену -2. Для розрахунку ступіні
окиснення атома Хрому складемо алгебраїчне
рівняння:
-
у атома Калію ступінь окиснення +1, у
атома Оксигену -2. Для розрахунку ступіні
окиснення атома Хрому складемо алгебраїчне
рівняння:
(+1) 2 + 2х + (2) 7 = 0 ;
х = + 6
Ступінь окиснення Хрому +6.
в) В сполуці Cr2(SO4)3 - атом Оксигену має ступінь окиснення -2, а у атомів Хрому та Сульфуру - вона невідома. В цьому випадку треба згадати, що дана сіль - сіль сульфатної кислоти Н2SO4, і заряд кислотного залишку дорівнює 2- (Н2SO42Н++ SO42-). Тоді загальна сума зарядів в цьому йоні
(![]() )2-
повинна
дорівнювати заряду йона, тобто 2-.
Розрахуємо ступінь окиснення Сульфуру:
)2-
повинна
дорівнювати заряду йона, тобто 2-.
Розрахуємо ступінь окиснення Сульфуру:
х + (2) 4 = 2 ;
х = + 6
Враховуючи заряд кислотного залишку та їх кількість можна розрахувати заряд атома Хрому:
2х + (2) 3 = 0 ;
х = + 3 .
При складанні хімічних рівнянь окисно-відновних реакцій застосовують, як правило, два метода:
метод електронного балансу, в основі якого лежить вирівнювання загального числа електронів, які атоми віддають чи приймають, в результаті чого змінюються їх ступіні окиснення;
метод йонно-електронного балансу, який передбачає вирівнювання зарядів реальних йонів до та після реакції.
