
- •Теоретична частина
- •Загальна характеристика р-елементів ііі групи
- •Фізичні та хімічні властивості алюмінію
- •Застосування алюмінію
- •1.4. Загальна характеристика р-елементів іv групи
- •1.5. Фізичні та хімічні властивості олова
- •Властивості сполук олова
- •Застосування олова
- •Властивості свинцю та його сполук
- •Ііі та іv груп пс
- •Запитання для самоконтролю і контролю знань
- •3. Приклади розв’язання задач для самостійної роботи
- •4. Завдання для самоконтролю
- •5. Експериментальна частина
Лабораторна робота 13
Тема: Хімічні властивості р-елементів ІІІ та ІV груп періодичної системи Д.І. Менделєєва
Мета та основні завдання:
удосконалити знання студентів із структури, критеріїв періодичності періодичної системи Д.І. Менделєєва, особливостей будови атомів металів;
удосконалити знання студентів з фізичних та хімічних властивостей металів; способів утворення та застосування металів;
удосконалити уміння студентів складати молекулярні рівняння хімічних реакцій, рівняння окисно-відновних реакцій; іонні рівняння;
удосконалити уміння студентів в розв’язанні задач за формулами та рівняннями;
формувати у студентів уміння працювати в складі малих груп;
формувати уміння студентів давати визначення поняттям;
розвивати комунікативні уміння студентів;
розвивати системне мислення студентів;
розвивати професійні навички студентів в роботі з хімічними реактивами та хімічним обладнанням.
Прикладні задачі: розглянути особливості будови атомів р-елементів ІІІ та ІV груп ПС; фізичні та хімічні властивості простих і складних речовин, утворених р-елементами ІІІ та ІV груп ПС; способи утворення даних речовин; їх застосування.
Ключові поняття: р-електрон, р-елемент, метали, фізичні властивості металів, хімічні властивості металів, способи утворення металів, застосування металів.
Теоретична частина
Хімічні елементи, на електронних оболонках яких заповнюється електронами р-підрівень зовнішнього енергетичного рівня, називаються р-елементами. Р-елементи знаходяться в ІІІ - VІІІ групах головних підгрупах періодичної системи. Р-елементи утворюють як прості речовини метали, так і неметали. Проаналізуйте зміну металічних властивостей елементів в групах і періодах та поясніть, чому в кожній наступній групі (від ІІІ до VІІІ) кількість р-елементів, які утворюють метали, зменшується.
Загальна характеристика р-елементів ііі групи
До р-елементів ІІІ групи періодичної системи відносяться Бор В, Алюміній Al, Галій Ga, Індій In, Талій Tl. Всі елементи крім Бора утворюють прості речовини метали. Ці атоми містять на s- і р-підрівнях зовнішнього енергетичного рівня три валентних електрона s2p1. Так, атом Алюмінію в стаціонарному стані має електронну будову:


 1s22s22p63s23p1
1s22s22p63s23p1
 один р-електрон
один р-електрон
 неспарений -
неспарений -
валентний
1s2 2s2 2p6 3s2 3p1
В збудженому стані один s-електрон зовнішнього енергетичного рівня переходить на р-підрівень:
три неспарених електрона:
один s- і два р-електрона -
три валентних електрона
1s2 2s2 2p6 3s1 3p2
Наявність трьох валентних електронів атома Алюмінію в збудженому стані обумовлює його валентність в сполуках – ІІІ, ступінь окиснення +3.
Такий ступінь окиснення проявляють в сполуках і атоми Ga, In, Tl. Але металічні властивості атомів посилюються Al → Ga → In →Tl. Поясніть, чому? Атом Талію може в сполуках проявляти і ступінь окиснення +1.
Оксиди та гідроксиди Алюмінію, Галію, Індію амфотерні, а оксиди Талію Tl2О, Tl2О3 характеризуються тільки основними властивостями.
Метали галій і індій мають кристалічні решітки, не характерні для металів (галій – ромбічну, індій – тетрагональну). При цьому в вузлах кристалічної решітки галію знаходяться не окремі атоми та іони, а двохатомні молекули Ga2, для руйнування яких необхідна значна енергія. Галій плавиться при температурі 300С. В розплавленому стані двохатомні молекули галію частково дисоціюють, утворюючи іони та окремі атоми, зв’язані металевим зв’язком. Тому електрична провідність рідкого галію вища, ніж у твердому стані.
Фізичні та хімічні властивості алюмінію
Алюміній Al самий розповсюджений метал в природі. Це сріблясто-білий легкий, пластичний метал, який має високі тепло- та електропровідність. Константи, які характеризують деякі фізичні та хімічні властивості алюмінію:
густина, г/см3 2,7
температура плавління, 0С 660
температура кипіння, 0С 2520
електронегативність (Lі – 1) 1,5
стандартний електродний
потенціал, В -1,66.
Алюміній – хімічно активний метал. Має високу хімічну спорідненість до Оксигену (∆G0298(утв. Аl2О3) = -1582 кДж / моль):
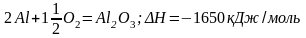 .
.
На повітрі алюміній утворює дуже міцну оксидну плівку (10-8 м) Al2О3. Завдяки оксидній плівці поверхня металу має високу корозійну стійкість по відношенню до води та до водяної пари, а також по відношенню до концентрованої сульфатної та нітратної кислот. Ці кислоти на холоду пасивують алюміній. При високих температурах міцність захисної плівки знижується. При відсутності оксидної плівки алюміній стає дуже реакційно здатним. Він взаємодіє:
з неметалами-окисниками:
за кімнатної температури з галогенами:
2Al + 3Cl2 = 2AlCl3 (алюміній хлорид);
2Al + 3Br2 = 2AlBr3 (алюміній бромид);
за високих
 температур з іншими неметалами:
температур з іншими неметалами:
2Al + N2
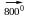 2AlN (алюміній нітрид);
2AlN (алюміній нітрид);
4Al + 3С
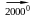 Al4С3 (алюміній
карбід).
Al4С3 (алюміній
карбід).
з розчинами кислот:
неокисників 2Al + 6НСl = 2AlСl3 + 3Н2↑;
2Al + 3H2SO4(розб.) = 2Al2(SO4)3 + 3Н2↑.
окисників (HNO3 розб.)
8Al + 30HNO3 = 8Al(NO3)3 + 3N2O +15Н2О.
з розчинами луг при нагріванні:
2Al + 6NaOH + 6H2О = 2Na3[Al(OH)6] + 3H2↑.
Проаналізуйте, чому алюміній реагує і з кислотами і з лугами? Складіть рівняння хімічних реакцій поетапного проходження останнього процесу.
4) алюміній легко віднімає Оксиген у
оксидів і солей інших металів.
Наприклад: 8Al + 3Fe3O4 4Al2O3
+ 9Fe.
4Al2O3
+ 9Fe.
Реакція супроводжується виділенням великої кількості теплоти: 3500 кДж/моль і розвивається температура до 30000С.
Як називається цей метод добування металів? Які метали добуваються цим методом?
