
- •Теоретична частина
- •Загальна характеристика р-елементів ііі групи
- •Фізичні та хімічні властивості алюмінію
- •Застосування алюмінію
- •1.4. Загальна характеристика р-елементів іv групи
- •1.5. Фізичні та хімічні властивості олова
- •Властивості сполук олова
- •Застосування олова
- •Властивості свинцю та його сполук
- •Ііі та іv груп пс
- •Запитання для самоконтролю і контролю знань
- •3. Приклади розв’язання задач для самостійної роботи
- •4. Завдання для самоконтролю
- •5. Експериментальна частина
Ііі та іv груп пс
Характеристика елементів і їх сполук |
Al |
Sn |
Pb |
Валентні електрони |
3 |
4 - s2p2 |
4 - s2p2 |
Проявляє ступені окиснення |
+3 |
-4, +2, +4 найбільш характерний +4 |
-4, +2, +4, найбільш характерний +2 |
Взаємодія металів з НNO3 |
концентровану пасивує, з розбавленою як метал |
з концентрованою як неметал, з розбавленою як метал |
з концентрованою та з розбавленою як метал |
Оксиди та їх характер |
Al2О3 амфотерний |
SnO амфотерний, більше основний SnO2 амфотерний, більше кислотний |
PbO амфотерний, більше основний PbO2 амфотерний, більше кислотний |
Гідроксиди та їх характер |
Al(ОН)3 амфотерний |
Sn(OН)2 амфотерний, більше основний Sn(OН)4 амфотерний, більше кислотний |
Pb(OН)2 амфотерний, більше основний Pb(OН)4 амфотерний, більше кислотний |
Окисно-відновні властивості сполук |
AlCl3 не прявляються |
сильні відновники SnCl2 Sn(OН)2 окиснення SnCl2⟶ SnCl4 Sn(OН)2⟶ Sn(OН)4 |
сильні окисники PbO2, РbCl4 PbO2⟶ РbSO4 відновлення РbCl4 ⇄ РbCl2 |
Леткі водневі сполуки |
Не утворюються |
SnН4 |
РbН4 |
Проаналізуйте дану таблицю. Поясніть зміну властивостей хімічних елементів Al, Sn, Pb та їх сполук за положенням в періодичній системі Д.І. Менделєєва.
Запитання для самоконтролю і контролю знань
В чому полягають особливості будови атомів р-елементів?
2. Які ступені окиснення в сполуках проявляють р-елементи ІІІ та ІV груп ПС? Чому?
3. У вигляді яких мінералів Алюміній, Станум, Плюмбум знаходяться в природі?
4. На прикладах простих речовин металів, які утворюють дані хімічні елементи, поясніть явище алотропії.
5. Порівняйте фізичні властивості даних металів.
6. Складіть рівняння хімічних реакцій, які підтверджують хімічні властивості алюмінію, олова, свинцю.
7. Поясніть характер оксидів та гідроксидів даних металів. Доведіть це за допомогою рівнянь хімічних реакцій.
8. Поясніть окисно-відновні властивості сполук даних металів. Доведіть це за допомогою рівнянь хімічних реакцій.
9. Як хімічним способом довести наявність амфотерних властивостей сполук даних металів?
10. Як застосовуються дані метали та їх сполуки в промисловості? Які сплави з них виготовляють?
3. Приклади розв’язання задач для самостійної роботи
1. Який об’єм одномолярного розчину натрій гідроксиду необхідно взяти, щоб розчинити 5 г сусального золота?
Реакція проходить за рівнянням:
SnS2 + 6NaОН = Na2[Sn(OH)6] + 2Na2S.
Розрахуємо кількість речовини ν SnS2:

За рівнянням реакції: ν(NaОН) = ν(SnS2)∙6 = 0,03∙6 = 0,18 моль.
Об’єм одномолярного розчину натрій гідроксиду обчислимо за формулою:
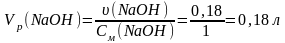 .
.
2. При спалюванні 4 г сплаву сульфідів алюмінію та заліза утворилось 3,904 г рідкого сульфур (IV) оксиду. Визначте масові частки обох речовин в сплаві.
Реакції горіння сульфідів алюмінію та заліза проходять за рівняннями реакцій:
2Al2S3 + 9O2 = 2Al2O3 + 6SO2↑;
2FeS + 7O2 = 2Fe2O3 + 4SO2↑.
Якщо масу алюміній сульфіду в сплаві позначити через х, то маса ферум (ІІ) сульфіду буде (4 - х) г. Для складання алгебраїчного рівняння використаємо схеми з урахуванням молярних мас речовин:
х г
Al2S3 ⟶ 3SO2 ;
150 г 3∙64 г
(4 - х) г
FeS ⟶ SO2 .
Всього в результаті реакції отримали 3,904 г SO2, тому:
 ;
;
 ;
;
88х + 50(4-х) = 0,061∙50 ∙ 88;
х = 1,8 г; m(Al2S3) = 1,8 г.
 ;
;
m(FeS) = 4 – 1,8 = 2,2 г;
ω% (FeS) = 100% - 45% = 55%.
3. До 200 мл одномолярного розчину алюміній сульфату додали 300 мл розчину калій гідроксиду концентрацією 7 моль/л. Визначте масу осаду та молярну концентрацію розчинів солей, які утворились.
Реакції в даних розчинах відбуваються за рівняннями:
Al2(SO4)3 + 6КОН = 2Al(ОН)3 + 3К2SO4 (1)
Al(ОН)3 + 3КOH = К3[Al(OH)6]. (2)
Розрахуємо кількість речовин Al2(SO4)3 та КОН в розчинах за формулою: υ = См ∙ Vр;
υ (Al2(SO4)3) = 0,2 ∙1 = 0,2 моль;
υ (КOH) = 0,3 ∙7 = 2,1 моль.
За рівнянням реакції речовини Al2(SO4)3 та КOH знаходяться в співвідношеннях 1:6. Розрахунок кількості речовин за умовою задачі показує, що КОН знаходиться в надлишку (0,2 ∙ 6 = 1,2 ˂ 2,1), тому в розчині утворюється дві солі: К2SO4 та К3[Al(OH)6]. Розрахуємо масу осаду Al(ОН)3, який утворився. За рівнянням реакції (1):
υ (Al(ОН)3) = υ(Al2(SO4)3) ∙ 2 = 0,2 ∙ 2 = 0,4 моль;
m(Al(ОН)3) = 0,4 ∙ М(Al(ОН)3) = 0,4 ∙78 = 31,2 г.
Розрахуємо молярну концентрацію утвореного розчину:
а) за К2SO4.
За рівнянням реакції (1):
υ(К2SO4) = υ(Al2(SO4)3) ∙ 3 = 0,2 ∙ 3 = 0,6 моль.
Vрозчину = 200 мл + 300 мл = 500 мл.
Тоді См(К2SO4)
=
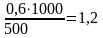 моль/л.
моль/л.
б) за К3[Al(OH)6].
Залишилось КОН: 2,1 – (0,2 ∙ 6) = 0,9 моль. За рівнянням реакції (2):
υ(К3[Al(OH)6])
=
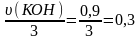 моль.
моль.
Тоді См(К3[Al(OH)6])
=
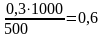 моль.
моль.

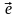 - s2p1
- s2p1