
- •Теоретична частина
- •Загальна характеристика s-елементів і групи
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Утворення та застосування лужних металів
- •Загальна характеристика s-елементів іі групи
- •1.6. Властивості та застосування берилію, магнію, лужноземельних металів та їх сполук
- •Кальцій і його сполуки
- •І та іі груп пс
- •Запитання для самоконтролю і контролю знань
- •Приклади розв’язання задач для самостійної роботи
- •Завдання для самоконтролю
- •5. Експериментальна частина
Утворення та застосування лужних металів
Висока хімічна активність лужних металів виключає можливість знаходження їх в природі у вільному стані. Вони зустрічаються в природі тільки у вигляді сполук. Найбільш розповсюджені в природі натрій і калій, які зустрічаються у вигляді хлоридів, сульфатів, силікатів і деяких інших сполук. Літій, рубідій та цезій входять до складу кристалічних ґраток мінералів тих елементів, яким вони близькі за атомним та іонним радіусом. Наприклад, літій зустрічається в мінералах разом з магнієм та залізом. Францій, не маючи стабільних ізотопів, знаходиться в мізерних кількостях в радіоактивних рудах актинію та урану.
Застосувавши матеріал лабораторної роботи 10, пригадайте способи утворення лужних металів.
Літій використовують в атомній енергетиці для утворення ізотопу Гідрогену тритію:
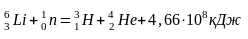
Невеликі кількості літію, додані до сталі і чавуну, підвищують їх міцність і твердість завдяки зв’язуванню літієм водню, кисню і азоту при плавці металу. Від додавання 0,012% (мас.) літію електрична провідність і густина міді збільшуються (внаслідок очистки міді від газів і сірки), а у сплавах алюмінію з вмістом 1% літію підвищується його корозійна стійкість та механічна міцність.
Натрій служить каталізатором в виробництві синтетичного каучуку. У вигляді амальгами (сплав зі ртуттю) натрій використовують як відновник. З багатьма металами натрій утворює інтерметалічні сполуки (NaSn6, NaSn4, NaSn3 та інші), з деякими – тверді розчини, з калієм – евтектичний сплав (24% Na і 76% К) з температурою плавлення 12,60С, який в рідкому стані використовують в якості теплоносія в атомних реакторах. Значні кількості натрію використовують і для утворення натрій пероксиду.
Велике значення мають сполуки лужних металів. Натрій хлорид (поварена сіль) широко використовується в побуті та (кам’яна сіль) як сировина для утворення кальцинованої Nа2СО3, харчової Nа2НСО3 і каустичної NаОН соди, а також хлору та інших речовин. Найбільшим споживачем натрій гідроксиду (каустичної соди) є виробництво синтетичного волокна. ЇЇ використовують також для омилювання жирів, в шкіряній та текстильній промисловості.
Практичну цікавість представляють натрій та калій пероксиди, які використовуються для регенерації кисню на підводних човнах і в ізолюючих протигазах:
Nа2О2 + 2СО2 = 2Nа2СО3 + О2↑.
Крім того, натрій пероксид використовують в якості відбілюючого засобу. В цьому випадку використовують здатність натрій пероксиду гідролізуватись з утворенням гідроген пероксиду:
Nа2О2 + 2H2O = 2NаОН + H2O2.
Із загальної кількості калійних сполук, які утворюють із руд, найбільшу кількість використовують в якості мінеральних добрив: КCl, K2SO4 та KNO3.
Загальна характеристика s-елементів іі групи
В головну підгрупу ІІ групи ПС входять Берилій Ве, Магній Mg, Кальцій Ca, Стронцій Sr, Барій Ba, Радій Ra. Останні чотири елемента називають лужноземельними, тому що їх гідроксиди Ме(ОН)2 мають лужні властивості, а їх оксиди МеО за своєю тугоплавкістю схожі з оксидами важких металів, які раніше називали землями.
Атоми всіх вищеназваних елементів в стаціонарному стані на зовнішньому енергетичному шарі мають по два спарених електрона (табл. 12.2). В збудженому стані один з двох зовнішніх електронів займає р-орбіталь (s1p1), в зв’язку з чим атоми можуть бути двохвалентними.
Таблиця 12.2 Деякі властивості атомів елементів головної підгрупи ІІ групи
Елемент |
Порядковий номер в ПС |
Конфігурація зовнішнього та предзовнішнього енергетичних шарів |
Радіус, нм |
Енергія іонізації, кДж/моль |
Відносна електронегативність (за Полінгом) |
|||
атома |
іона |
|||||||
Be Mg Ca Sr Ba Ra |
4 12 20 38 56 88 |
1s22s2 2s22p63s2 3s23p64s2 4s24p65s2 5s25p6 6s2 6s26p6 7s2
|
0,1040 0,1279 0,1690 0,1836 0,2060 0,2042 |
0,0139 0,0246 0,0538 0,0683 0,0866 - |
899 736 590 548 502 510 |
1,5 1,2 1,0 1,0 0,9 0,9 |
||
Порівняйте властивості атомів та поясніть зміну властивостей простих речовин металів, які утворюють дані хімічні елементи.
Радіуси атомів елементів головної підгрупи ІІ групи менші, ніж у атомів відповідних лужних металів, а енергія іонізації більша, тому елементи головної підгрупи ІІ групи (крім берилію) мають чітко виявлені металічні властивості і поступаються в цьому тільки лужним металам.
