
- •Глава 11. Гормоны
- •Способы взаимодействия сигналов и клеток мишеней многообразны
- •В основе взаимодействия сигнала и рецептора лежит слабое взаимодействие
- •Механизм передачи сигнала в клетку определяется особенностями свойств рецептора.
- •Все рецепторы можно разделить на две группы
- •Эндокринная сигнальная система одна из ведущих регулирующих систем в организме.
- •Уровень гормона в крови не всегда определяет конечный эффект гормона
- •Передача сигнала рецепторами, связанными с g-белками проходит с участием вторичных посредников
- •Образование вторичных посредников – дело интегральных белков плазматической мембраны.
- •ЦАмф - первый вторичный посредник в истории исследований переноса сигналов
- •ЦАмф- аллостерический регулятор протеинкиназы а (пка).
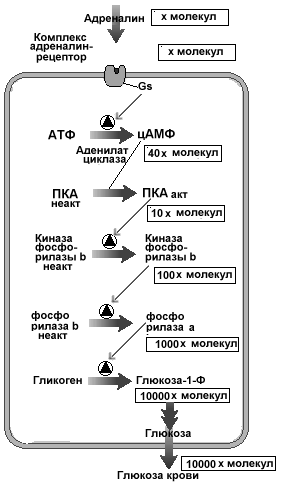
- •В каскадном механизме передачи сигнала заложен механизм усиления сигнала
- •На каждом этапе каскадного механизма усиления сигнала есть свои выключатели.
- •Два вторичных посредника образуются из фосфатидилинозитолов мембран
- •Иф3 обеспечивает повышение уровня ионов кальция в цитозоле.
- •Обе ветви инозитолфосфолипидного пути действуют совместно
- •Разные пути передачи сигнала с участием 7 тмс рецепторов взаимодействуют между собой
- •Многие рецепторы сами обладают ферментативной активностью.
- •Наиболее широко распространенная группа 1тмс рецепторов в клетках – рецепторные тирозинкиназы (ртк).
- •Фосфорилированные тирозиновые остатки связываются со специфическими доменами белков.
- •В механизме передачи сигнала с участием 1тмс рецепторов тоже есть система усиления сигнала.
- •Рецепторы, взаимодействующие с тирозинкиназами по механизму действия подобны рецепторным тирозинкиназам
- •1Тмс рецепторы могут обладать и серин/треонин протеинкиназной активностью.
- •Сигнальные гидрофобные молекулы взаимодействуют с внутриядерными и цитозольными рецепторами
- •Гормоны гипоталамуса и гипофиза
- •Нейроны гипоталамуса –нейросекреторные клетки
- •Гормоны передней доли гипофиза можно разделить на три группы.
- •Великаны и карлики- следствие нарушений функций гормона роста
- •В механизмах действия гормона роста участвуют посредники
- •Конечный эффект гормона роста на метаболизм определяется сочетанием прямого и опосредованного ифр влияния на клетки
- •Самые сложные белковые гормоны.
- •Гонадотропины- гормоны регулирующие функциональную активность половых желез
- •Секреция актг изменяется в течении суток.
- •Липотропин - источник эндогенных опиатов
- •Гормоны задней доли гипофиза
- •Вазопрессин – антидиуретический гормон.
- •Основной физиологический эффект окситоцина соответствует названию гормона.
- •Несахарное мочеизнурение – форма проявления функциональной недостаточности вазопрессина.
- •Гормоны щитовидной железы
- •В синтезе гормонов щитовидной железы можно выделить 4 этапа
- •Все клетки организма, по-видимому, мишени гормонов щитовидной железы.
- •Калоригенное влияние, по-видимому, первично в действии гормонов на организм
- •О системных эффектах гормонов можно судить, сопоставляя изменения, наблюдаемые при гипо и гиперфункциях железы
- •Развитию гипотиреоза у взрослых может предшествовать увеличение размеров щитовидной железы- зоб
- •Гипотиреоз у плода и новорожденного приводит к нарушению роста и развития.
- •Увеличение размеров щитовидной железы может быть признаком гиперфункции
- •Увеличение размеров щитовидной железы может быть следствием применения антитиреоидных средств.
- •Кальцитонин- гормон-полипептид
- •Паращитовидные железы – регуляторы обмена кальция и фосфора
- •Гормоны поджелудочной железы
- •Молекулы инсулина обладают видовой специфичностью
- •Синтез инсулина проходит по законам синтеза секретируемых белков
- •В регуляции синтеза самого инсулина и в механизме его действия важную роль играют переносчики глюкозы
- •Инсулин-«гормон изобилия»
- •Эффекты инсулина тканеспецифичны.
- •Активирование поступления глюкозы в адипоцит сопровождается ингибированием липолиза
- •Инсулиновый рецептор и его субстрат активируют путь передачи сигнала с участием гтф-азы.
- •Комплекс нарушений, вызванных недостаточностью функций инсулина называется сахарным диабетом.
- •Снижение толерантности к глюкозе при диабете - следствие нарушения использования глюкозы периферическими тканями
- •Гипергликемия при диабете – причина «диабета».
- •Длительная гипергликемия способствует неферментативному гликозилированию белков
- •Избыток глюкозы вне клеток при диабете контрастирует с ее внутриклеточным дефицитом.
- •Диабет – болезнь липидного обмена?
- •Кетоновые тела –важный источник энергии.
- •Кетоновые тела – источник протонов
- •Выделяют две формы диабета.
- •Высокие дозы инсулина также ведут к коме
- •Падение уровня глюкозы компенсируется специальными механизмами.
- •Глюкагон образуется а- клетками поджелудочной железы
- •Глюкагон действует через 7тмс рецепторы
- •Основной регулятор секреции глюкагона - глюкоза
- •Молярное отношение инсулин :глюкагон - важный показатель состояния регуляторных систем метаболизма.
- •Панкреатический полипептид синтезируется f- клетками поджелудочной железы
- •Гормоны надпочечников Гормоны коры надпочечников - производные холестерола.
- •Основной исходный субстрат для синтеза гормонов коры надпочечников – холестерол.
- •Прегненолон –прямой предшественник всех стероидных гормонов.
- •Клетки гломерулярной зоны синтезируют альдостерон потому, что у них есть синтаза альдостерона
- •Транскортин- главный транспортный белок стероидных гормонов
- •Печень –основной орган катаболизма стероидных гормонов надпочечников
- •Секреция актг и кортикостероидов подвержена циркадным ритмам
- •Регуляция секреции альдостерона мало зависит от актг
- •Ведущий фактор в регуляции секреции альдостерона – ренин –ангиотензиновая система.
- •Ангиотензин II– гипертезин
- •Глюкокортикоидные гормоны стимулируют образование глюкозы.
- •Существует тканевая специфичность в действии глюкокортикостероидов на липидный обмен.
- •На обмен белков глюкортикостероидов оказывают двоякий эффект
- •Высокие концентрации глюкокортикоидов тормозят иммунологический ответ.
- •Высокие концентрации глюкокортикоидов подавляют воспалительную реакцию.
- •Глюкокортикоиды оказывают влияние практически на все органы и системы
- •Для проявления своей активности альдостерон связывается с внутриклеточным рецептором.
- •Недостаточность ферментов, катализирующих синтез кортикостероидов, ведет к гиперплазии надпочечников.
- •Синдром Кушинга развивается при избытке глюкокортикоидов.
- •Первичная недостаточность надпочечников - аддисонова болезнь.
- •Первичный альдостеронизм – болезнь Кона
- •Гормоны мозгового слоя надпочечников образуются из тирозина
- •Период полураспада катехоламинов составляет 1- 2 минуты.
- •Феохромоцитомы – опухоли, ведущие к гипертензии
- •Гормоны половых желез
- •Клетки Лейдига –основное место синтеза андрогенов
- •Белки плазмы обеспечивают транспорт гормонов к органам мишеням
- •Тестостерон действует через внутриклеточные рецепторы
- •Конечный эффект тестостерона определяется его концентрацией, которая тщательно регулируется.
- •Недостаточность мужских половых гормонов может проявляться по разному
- •Яичники –источник женских половых гормонов и половых клеток
- •Эстрогены образуются их андрогенов
- •Основной источник прогестерона – желтое тело
- •Количество синтезируемых гормонов зависит от возраста и фазы менструального цикла
- •Желтое тело после оплодотворения – железа внутренней секреции
- •Плацента секретирует свой гормон роста.
- •Фетоплацентарная единица –кооперация в синтезе стероидных гормонов
- •Резкое снижение уровня эстрогенов инициирует лактацию после родов
- •Гинекомастия – развитие молочных желез у мужчин
- •Менопауза – результат снижения активности яичников.
- •Эстрогены регулируют синтез белков
- •Бесплодие – одна из важных медицинских проблем.
- •Гормоны желудочно-кишечного тракта.
- •Организация эндокринной системы желудочно-кишечного тракта отличается рядом особенностей
- •Секретин - первый гормон в истории эндокринологии
- •Инкретины –гормоны стимулирующие секрецию инсулина.
- •Вазоактивный интестинальный полипептид член семейства секретина
- •Мотилин не входит ни в семейство гастрина ни в семейство секретина
- •Механизмы действия многих гормонов жкт еще не известны.
ЦАмф - первый вторичный посредник в истории исследований переноса сигналов
 Эрл
Уилбер Сазерленд, американский биохимик,
в середине 50-х годов ХХ столетия, при
исследовании механизма активирования
распада гликогена под влиянием адреналина
и глюкагона обнаружил, что эти гормоны
не оказывают непосредственного влияния
на распад гликогена. При инкубации
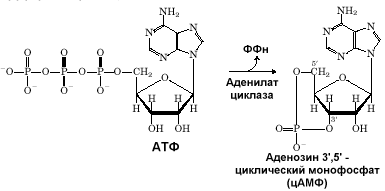
мембран клеток печени в присутствии
АТФ в среде появлялось термостабильное
соединение, которое Сазерленд
идентифицировал как циклическую
адениловую кислоту (цАМФ). Это соединение
возникало из АТФ под влиянием фермента,
который он назвал аденилатциклазой.
К
Эрл
Уилбер Сазерленд, американский биохимик,
в середине 50-х годов ХХ столетия, при
исследовании механизма активирования
распада гликогена под влиянием адреналина
и глюкагона обнаружил, что эти гормоны
не оказывают непосредственного влияния
на распад гликогена. При инкубации
мембран клеток печени в присутствии
АТФ в среде появлялось термостабильное
соединение, которое Сазерленд
идентифицировал как циклическую
адениловую кислоту (цАМФ). Это соединение
возникало из АТФ под влиянием фермента,
который он назвал аденилатциклазой.
К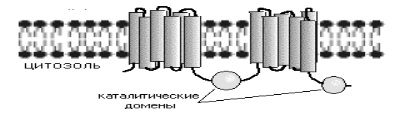 ак
оказалось аденилатциклаза широко
распространенный мембраносвязанный
белок, состоящий из 1100 аминокислот,
которые формируют 2 кластера по 6
трансмембранных сегментов, разделенных
на цитоплазматической стороне двумя
каталитическими доменами. Известны к
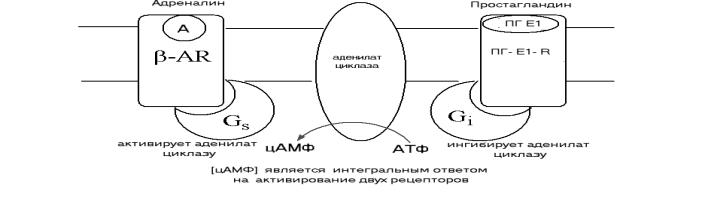
настоящему времени 6 типов Рис.11.6. Влияние
адреналина и простагландина Е1 на
активность аденилатциклазы
ак
оказалось аденилатциклаза широко
распространенный мембраносвязанный
белок, состоящий из 1100 аминокислот,
которые формируют 2 кластера по 6
трансмембранных сегментов, разделенных
на цитоплазматической стороне двумя
каталитическими доменами. Известны к
настоящему времени 6 типов Рис.11.6. Влияние
адреналина и простагландина Е1 на
активность аденилатциклазы
аденилатциклаз. Активность этих ферментов регулируется G- белками. В зависимости от типа аденилатциклаз, они могут взаимодействовать с sсубъединицейGбелка и переходить в активное состояния или с I cубъединицей и ингибироваться.
На рис 11.6 приводится обобщенное представление о интегральном ответе аденилатциклазы. Одна и та же молекула не может взаимодействовать с двумя регуляторами с противоположным действием.
Уровень цАМФ в клетках очень низок (< 10-7М), но при активировании аденилатциклазы может быстро( секунды) увеличиться в несколько раз. Однако это повышение бывает кратковременным. Распад цАМФ катализируется цАМФ-фосфодиэстеразами (ФДЭ). Эти ферменты катализируют гидролиз фосфодиэфирной связи в молекуле цАМФ с образованием аденозин-5-монофосфата. Активность ФДЭ также можно регулировать. Известно, например, что некоторые производные пурина (кофеин) могут быть ингибиторами этого фермента, что также может приводить к повышению уровня цАМФ.
ЦАмф- аллостерический регулятор протеинкиназы а (пка).
 Эффект
усиления распада гликогена, наблюдаемый
Сазерлендом не был результатом прямого
влияния цАМФ на фосфорилазу гликогена.
Активность фосфорилазы изменялась
путем ее фосфорилирования при участии
еще одного фермента ц-АМФ-зависимой
протеинкиназы (протеинкиназы А - ПКА).
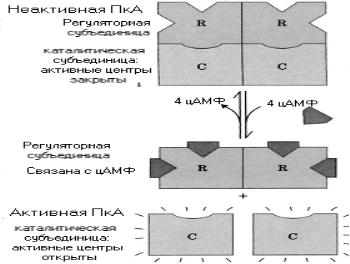
ЦАМФ является аллостерическим активатором
протеинкиназы. В последующем было
выделено несколько типов ПКА, имеющих
схожее строение в разных тканях. Это
гетеромеры, состоящие из 2-х каталитических
(С2) и одной регуляторной субъединицы,
состоящей из двух полипептидных цепей
(R2).
Эффект
усиления распада гликогена, наблюдаемый
Сазерлендом не был результатом прямого
влияния цАМФ на фосфорилазу гликогена.
Активность фосфорилазы изменялась
путем ее фосфорилирования при участии
еще одного фермента ц-АМФ-зависимой
протеинкиназы (протеинкиназы А - ПКА).
ЦАМФ является аллостерическим активатором
протеинкиназы. В последующем было
выделено несколько типов ПКА, имеющих
схожее строение в разных тканях. Это
гетеромеры, состоящие из 2-х каталитических
(С2) и одной регуляторной субъединицы,
состоящей из двух полипептидных цепей
(R2).
Были выделены 3 типа каталитических () субъединиц и два типа регуляторных (I и II). Холоэнзимы R2С2неактивны. Присоединение цАМФ вызывает диссоциацию фермента. При этом каталитические субъединицы освобождаются и начинают активно катализировать перенос фосфорного остатка с АТФ на определенные остатки серина или треонина некоторых белков органа- мишени. Обычно специфичекой последовательностью аминокислот участков фосфорилирования АРГ-АРГ-Х-СЕР или ЛИЗ-АРГ-Х-Х-СЕР, где Х- любая аминокислота.
Такая ковалентная модификация фермента стабилизирует одно из конформационных состояний фермента: активное -расслабленное или неактивное- напряженное. Это уже зависит от свойств данного фермента. Так, фосфорилирование гликогенфосфорилазы активирует ее, а гликогенсинтетазы, наоборот, тормозит ее активность. Эффекты цАМФ обычно непродолжительны. В клетках имеются ферменты дефосфорилирующие белки, фосфорилируемые протеинкиназой А. Известны две главные протеинфосфатазы., одна из которых сама регулируется цАМФ. Последняя наиболее активна в отсутствии цАМФ.
Р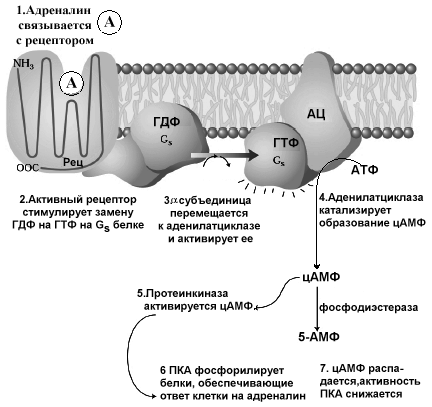 ис11.7.
Схема этапов влияния адреналина на
клетку
ис11.7.
Схема этапов влияния адреналина на
клетку
цАМФ может выполнять регуляторные функции и другими альтернативными механизмами, например, открытием цАМФ-зависимых ионных каналов. На рис 11.7 суммированы данные о механизме действия адреналина на адренэргический рецептор
|
Таблица 11.4.Некоторые клеточные ответы на действие гормонов, опосредуемое циклическим АМФ | ||
|
Гормон |
Клетки-мишени |
Главный ответ |
|
Тиротропин |
Тироциты |
Синтез и секреция тироксина |
|
Кортикотропин |
Клетки пучковой и сетчатой зоны коры надпочечников |
Секреция кортизола |
|
Лютропин |
Клетки Лейдига яичников |
Секреция прогестерона |
|
Адреналин |
Миоциты, гепатоциты |
Распад гликогена |
|
Паратгормон |
Остеокласты |
Резорбция кости |
|
Адреналин |
Р-клетки водителя ритма сердца |
Увеличение частоты сокращений |
|
Вазопрессин |
Эпителиоциты канальцев нефрона почки |
Реабсорбция воды |
|
Адреналин, кортикотропин, глюкагон, тиротропин |
Адипоциты |
Расщепление триацилглицеролов |
В таблице 11.4 представлены некоторые клеточные ответы на действие гормонов, активирующих аденилатциклазный путь сигнализации. Важно отметить, что разные лиганды, действующие через различные рецепторы на аденилатциклазу в данной клетке, обычно вызывают одну и ту же ответную реакцию. Например, в адипоцитах аденилатциклазу активируют по крайней мере четыре разных гормона, (адреналин, кортикотропин, глюкагон, тиротропин) и все они вызывают расщепление триацилглицеролов (резервная форма жира) до жирных кислот. Похоже, что различные рецепторы для этих гормонов активируют общий пул молекул аденилатциклазы.
 В
некоторых животных клетках повышение
уровня цАМФ приводит к активации
транскрипции определенных генов.
Например, в нейроэндокринных клетках
гипоталамуса цАМФ "включает" ген,
кодирующий синтез пептидного гормона
соматостатина. Каков же механизм этого
процесса? Дело в том, что активированная
каталитическая субъединица ПКА может
траслоцироваться из цитоплазмы в ядро.
На уровне ядерного компартмента влияние
протеинкиназы А реализуется через
фосфорилирование так называемых
ген-регуляторных белков (generegulatoryproteins),
которые, активируясь, связываются со
специфическими отвечающими элементами
(responseelements),
представляющими собой короткие участки
ДНК строго определенной последовательности
генов-регуляторов, формируя при этом
пусковое звено активации или репрессии
транскрипции соответствующего
транскриптона.
В
некоторых животных клетках повышение
уровня цАМФ приводит к активации
транскрипции определенных генов.
Например, в нейроэндокринных клетках
гипоталамуса цАМФ "включает" ген,
кодирующий синтез пептидного гормона
соматостатина. Каков же механизм этого
процесса? Дело в том, что активированная
каталитическая субъединица ПКА может
траслоцироваться из цитоплазмы в ядро.
На уровне ядерного компартмента влияние
протеинкиназы А реализуется через
фосфорилирование так называемых
ген-регуляторных белков (generegulatoryproteins),
которые, активируясь, связываются со
специфическими отвечающими элементами
(responseelements),
представляющими собой короткие участки
ДНК строго определенной последовательности
генов-регуляторов, формируя при этом
пусковое звено активации или репрессии
транскрипции соответствующего
транскриптона.
