
- •Глава 11. Гормоны
- •Способы взаимодействия сигналов и клеток мишеней многообразны
- •В основе взаимодействия сигнала и рецептора лежит слабое взаимодействие
- •Механизм передачи сигнала в клетку определяется особенностями свойств рецептора.
- •Все рецепторы можно разделить на две группы
- •Эндокринная сигнальная система одна из ведущих регулирующих систем в организме.
- •Уровень гормона в крови не всегда определяет конечный эффект гормона
- •Передача сигнала рецепторами, связанными с g-белками проходит с участием вторичных посредников
- •Образование вторичных посредников – дело интегральных белков плазматической мембраны.
- •ЦАмф - первый вторичный посредник в истории исследований переноса сигналов
- •ЦАмф- аллостерический регулятор протеинкиназы а (пка).
- •В каскадном механизме передачи сигнала заложен механизм усиления сигнала
- •На каждом этапе каскадного механизма усиления сигнала есть свои выключатели.
- •Два вторичных посредника образуются из фосфатидилинозитолов мембран
- •Иф3 обеспечивает повышение уровня ионов кальция в цитозоле.
- •Обе ветви инозитолфосфолипидного пути действуют совместно
- •Разные пути передачи сигнала с участием 7 тмс рецепторов взаимодействуют между собой
- •Многие рецепторы сами обладают ферментативной активностью.
- •Наиболее широко распространенная группа 1тмс рецепторов в клетках – рецепторные тирозинкиназы (ртк).
- •Фосфорилированные тирозиновые остатки связываются со специфическими доменами белков.
- •В механизме передачи сигнала с участием 1тмс рецепторов тоже есть система усиления сигнала.
- •Рецепторы, взаимодействующие с тирозинкиназами по механизму действия подобны рецепторным тирозинкиназам
- •1Тмс рецепторы могут обладать и серин/треонин протеинкиназной активностью.
- •Сигнальные гидрофобные молекулы взаимодействуют с внутриядерными и цитозольными рецепторами
- •Гормоны гипоталамуса и гипофиза
- •Нейроны гипоталамуса –нейросекреторные клетки
- •Гормоны передней доли гипофиза можно разделить на три группы.
- •Великаны и карлики- следствие нарушений функций гормона роста
- •В механизмах действия гормона роста участвуют посредники
- •Конечный эффект гормона роста на метаболизм определяется сочетанием прямого и опосредованного ифр влияния на клетки
- •Самые сложные белковые гормоны.
- •Гонадотропины- гормоны регулирующие функциональную активность половых желез
- •Секреция актг изменяется в течении суток.
- •Липотропин - источник эндогенных опиатов
- •Гормоны задней доли гипофиза
- •Вазопрессин – антидиуретический гормон.
- •Основной физиологический эффект окситоцина соответствует названию гормона.
- •Несахарное мочеизнурение – форма проявления функциональной недостаточности вазопрессина.
- •Гормоны щитовидной железы
- •В синтезе гормонов щитовидной железы можно выделить 4 этапа
- •Все клетки организма, по-видимому, мишени гормонов щитовидной железы.
- •Калоригенное влияние, по-видимому, первично в действии гормонов на организм
- •О системных эффектах гормонов можно судить, сопоставляя изменения, наблюдаемые при гипо и гиперфункциях железы
- •Развитию гипотиреоза у взрослых может предшествовать увеличение размеров щитовидной железы- зоб
- •Гипотиреоз у плода и новорожденного приводит к нарушению роста и развития.
- •Увеличение размеров щитовидной железы может быть признаком гиперфункции
- •Увеличение размеров щитовидной железы может быть следствием применения антитиреоидных средств.
- •Кальцитонин- гормон-полипептид
- •Паращитовидные железы – регуляторы обмена кальция и фосфора
- •Гормоны поджелудочной железы
- •Молекулы инсулина обладают видовой специфичностью
- •Синтез инсулина проходит по законам синтеза секретируемых белков
- •В регуляции синтеза самого инсулина и в механизме его действия важную роль играют переносчики глюкозы
- •Инсулин-«гормон изобилия»
- •Эффекты инсулина тканеспецифичны.
- •Активирование поступления глюкозы в адипоцит сопровождается ингибированием липолиза
- •Инсулиновый рецептор и его субстрат активируют путь передачи сигнала с участием гтф-азы.
- •Комплекс нарушений, вызванных недостаточностью функций инсулина называется сахарным диабетом.
- •Снижение толерантности к глюкозе при диабете - следствие нарушения использования глюкозы периферическими тканями
- •Гипергликемия при диабете – причина «диабета».
- •Длительная гипергликемия способствует неферментативному гликозилированию белков
- •Избыток глюкозы вне клеток при диабете контрастирует с ее внутриклеточным дефицитом.
- •Диабет – болезнь липидного обмена?
- •Кетоновые тела –важный источник энергии.
- •Кетоновые тела – источник протонов
- •Выделяют две формы диабета.
- •Высокие дозы инсулина также ведут к коме
- •Падение уровня глюкозы компенсируется специальными механизмами.
- •Глюкагон образуется а- клетками поджелудочной железы
- •Глюкагон действует через 7тмс рецепторы
- •Основной регулятор секреции глюкагона - глюкоза
- •Молярное отношение инсулин :глюкагон - важный показатель состояния регуляторных систем метаболизма.
- •Панкреатический полипептид синтезируется f- клетками поджелудочной железы
- •Гормоны надпочечников Гормоны коры надпочечников - производные холестерола.
- •Основной исходный субстрат для синтеза гормонов коры надпочечников – холестерол.
- •Прегненолон –прямой предшественник всех стероидных гормонов.
- •Клетки гломерулярной зоны синтезируют альдостерон потому, что у них есть синтаза альдостерона
- •Транскортин- главный транспортный белок стероидных гормонов
- •Печень –основной орган катаболизма стероидных гормонов надпочечников
- •Секреция актг и кортикостероидов подвержена циркадным ритмам
- •Регуляция секреции альдостерона мало зависит от актг
- •Ведущий фактор в регуляции секреции альдостерона – ренин –ангиотензиновая система.
- •Ангиотензин II– гипертезин
- •Глюкокортикоидные гормоны стимулируют образование глюкозы.
- •Существует тканевая специфичность в действии глюкокортикостероидов на липидный обмен.
- •На обмен белков глюкортикостероидов оказывают двоякий эффект
- •Высокие концентрации глюкокортикоидов тормозят иммунологический ответ.
- •Высокие концентрации глюкокортикоидов подавляют воспалительную реакцию.
- •Глюкокортикоиды оказывают влияние практически на все органы и системы
- •Для проявления своей активности альдостерон связывается с внутриклеточным рецептором.
- •Недостаточность ферментов, катализирующих синтез кортикостероидов, ведет к гиперплазии надпочечников.
- •Синдром Кушинга развивается при избытке глюкокортикоидов.
- •Первичная недостаточность надпочечников - аддисонова болезнь.
- •Первичный альдостеронизм – болезнь Кона
- •Гормоны мозгового слоя надпочечников образуются из тирозина
- •Период полураспада катехоламинов составляет 1- 2 минуты.
- •Феохромоцитомы – опухоли, ведущие к гипертензии
- •Гормоны половых желез
- •Клетки Лейдига –основное место синтеза андрогенов
- •Белки плазмы обеспечивают транспорт гормонов к органам мишеням
- •Тестостерон действует через внутриклеточные рецепторы
- •Конечный эффект тестостерона определяется его концентрацией, которая тщательно регулируется.
- •Недостаточность мужских половых гормонов может проявляться по разному
- •Яичники –источник женских половых гормонов и половых клеток
- •Эстрогены образуются их андрогенов
- •Основной источник прогестерона – желтое тело
- •Количество синтезируемых гормонов зависит от возраста и фазы менструального цикла
- •Желтое тело после оплодотворения – железа внутренней секреции
- •Плацента секретирует свой гормон роста.
- •Фетоплацентарная единица –кооперация в синтезе стероидных гормонов
- •Резкое снижение уровня эстрогенов инициирует лактацию после родов
- •Гинекомастия – развитие молочных желез у мужчин
- •Менопауза – результат снижения активности яичников.
- •Эстрогены регулируют синтез белков
- •Бесплодие – одна из важных медицинских проблем.
- •Гормоны желудочно-кишечного тракта.
- •Организация эндокринной системы желудочно-кишечного тракта отличается рядом особенностей
- •Секретин - первый гормон в истории эндокринологии
- •Инкретины –гормоны стимулирующие секрецию инсулина.
- •Вазоактивный интестинальный полипептид член семейства секретина
- •Мотилин не входит ни в семейство гастрина ни в семейство секретина
- •Механизмы действия многих гормонов жкт еще не известны.
Наиболее широко распространенная группа 1тмс рецепторов в клетках – рецепторные тирозинкиназы (ртк).
В 1982 году впервые был открыт рецептор со свойствами тирозин -специфической протеинкиназы для эпидермального фактора роста (ЭФР). ЭФР- это маленький белок (53 аминокислоты), стимулирующий пролиферацию эпидермальных и некоторых других клеток. Его рецептор - классический 1TMS –рецептор. Он состоит из 1200 аминокислот и большой гликозилированной внеклеточной части, которая обеспечивает связывание ЭФР. При присоединении ЭФР активируется внутриклеточный домен, обладающий свойствами тирозинкиназы. Этот домен рецептора катализирует перенос остатка фосфорной кислоты на тирозиновый остаток самого рецептора и/или на тирозиновый остаток специфического внутриклеточного белка. Как оказалось, рецепторы многих других факторов роста также обладают свойствами тирозинкиназы и имеют ряд общих структурных и функциональных свойств. Можно выделить 4 основные домена в их структуре
Гликозилированный внеклеточный домен, связывающий лиганд.
Внутриклеточный домен с тирозинкиназной активностью.
Внутриклеточный регулирующий домен.
Трансмембранный домен
Аминокислотные последовательности тирозинкиназных доменов РТК высоко консервативны и подобны цАМФ зависимой протеинкиназе (ПкА)в областях связывания АТФ и субстратов. Некоторые РТК имеет вставки аминокислотных последовательностей в киназные домены названные киназными вставками. РТК классифицируются на семейства, на основе структурных особенностей их внеклеточных частей: наличие или отсутствие киназных вставок, богатых цистеинами последовательностей, иммуноглобулинподобных областей, лейцин – богатых областей и т.д. Выделяют на по крайней мере на 14 различных семейств РПК.
Некоторые рецепторные протеинкиназы могут катализировать фосфорилирование специальных белков цитозоля. Примером такого рода рецепторов является рецептор инсулина. Присоединение инсулина вызывает активирование его киназного домена, который помимо аутофосфорилирования, катализирует фосфорилирование остатков тирозина специального белка , названного субстратом инсулинового рецептора IRS-1.
Фосфорилированные тирозиновые остатки связываются со специфическими доменами белков.
Фосфотирозины , образующиеся в белках под влиянием рецеторной протеинкиназы затем служат местом присоединения и активирования многочисленных внутриклеточных белков.
Способность связываться с фосфорилированными тирозинами обусловлена специфическими доменами в структуре таких белков, названными SH2 иSH3 доменами. Впервые эти домены бы
ли обнаружены при исследовании механизмов развития опухолей (саркомы). Семейство протоонкогенов, выделенное при этих исследованиях и обладающих способностью связываться с тирозинами, получило название Src-семейства. Гомологичные домены, обнаруженные в других белках получили названиеSH2 и SH3 по аналогии с соответствующими участкамиSrcбелков ((S)rc(H)omologydomain2 или 3 ).
Среди таких белков можно назвать фосфатидилинозитол 3-киназу (ФИ-3), фосфолипазу С-белок, активирующий ГТФазу (GAP), Src –подобную нерецепторную тирозинкиназу и многие другие.
Существует группа белков, названных малыми SHадапторными белками и состоящими из 2 доменовSH2 иSH3 . Эти белки не обладают каталитической активностью, а выполняют связующую роль между активированными тирозинкиназами и другими белками, которые не имеют своихSH2 и SH3доменов.Известны и другие структуры, обеспечивающие узнавание фосфорилированных молекул.
Фосфорилированные тирозины, таким образом, являясь местом присоединения разнообразных белков, служат инициаторами целых каскадов реакций, направленных на усиление сигналов и специфическое включение или выключение определенных функций, необходимых для выживания клеток, их пролиферации или программированной гибели.
В передаче сигнала с участием 1ТМС рецепторов тоже есть выключатели.
В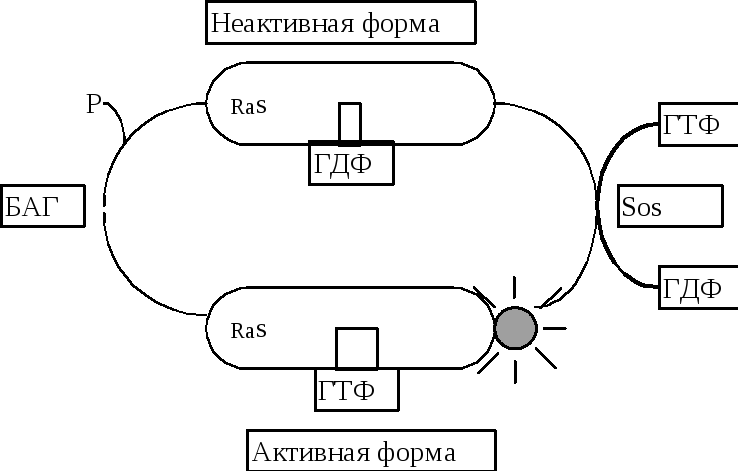 ажную
роль в в передаче сигналов с участием
активных рецепторных тирозинкиназ
играют Ras белки. Ras белки - это семейство
мономерных ГТФаз. ПодобноG-белкам
(тримерным ГТФазам), они содержат на
С-конце ковалентно связанный фарнезильный
или геранильный остаток. С помощью
такого гидрофобного конца белки Ras
(p21ras) прикрепляются к к цитоплазматической
стороне плазматической мембраны.
ажную
роль в в передаче сигналов с участием
активных рецепторных тирозинкиназ
играют Ras белки. Ras белки - это семейство
мономерных ГТФаз. ПодобноG-белкам
(тримерным ГТФазам), они содержат на
С-конце ковалентно связанный фарнезильный
или геранильный остаток. С помощью
такого гидрофобного конца белки Ras
(p21ras) прикрепляются к к цитоплазматической
стороне плазматической мембраны.
Ras белки участвуют в передаче сигнала от рецеторной тирозинкиназы к ядру при стимуляции клеточной пролиферации или дифференцировки факторами роста или гормонами. Если эти белки связать антителами, то нарушается передача информации и, как следствие, нарушается дифференцировка клеток , которая обычно вызывается активированием рецепторных тирозинкиназ. Как подобает мономерным ГТФазам, Ras белки могут переключать свою конформацию и быть активными, если к ним присоединяется ГТФ и становиться неактивными при замене ГТФ на ГДФ. Правда, Ras белки катализируют гидролиз ГТФ в 100 раз медленнее, чем большие тримерные G- белки и, учитывая высокую концентрацию ГТФ в клетке, Ras белки могут находиться в активном состоянии долго. Способность Ras белков взаимодействовать с ГТФ или катализировать ее гидролиз в свою очередь регулируется дополнительными белками. В клетках существуют 2 класса белков такого рода. Белок, активирующий ГТФазу (БАГ) усиливает степень гидролиза ГТФ Ras белками и поэтому инактивирует их, ингибируя передачу сигнала .
Этому негативному регулятору противостоит белок, который ускоряет освобождение связанного ГДФ и замену его на ГТФ из цитозоля и поэтому оказывает активирующий эффект на Ras белок. Этот белок называют фактором, высвобождающим гуаниловые нуклеотиды (guanylnucleotide relisyng protein GRP. На рис 12-15 он обозначен Sos). Ras белки и их регуляторы консервативны в эволюции и подобны по строению у разных видов живых организмов.
Фосфорилирование тирозина, катализируемое рецепторной протеинкиназой на цитоплазматической поверхности мембраны и активирование Ras длится короткий промежуток времени: специфические протеинфосфатазы катализируют дефосфорилирование тирозина, а активный Ras инактивируется путем гидролиза ГТФ, приостанавливая передачу сигнала внутрь клетки.
