
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 1. 1999г
..pdf
61
поэтому при более высоких температурах соединение состава AgCl·3NH3 не образуется, если давление аммиака не выше атмосферного.
P (мм. рт. ст.) |
P (мм. рт.ст.) |
H
50 |
|
|
700 |
|
F |
G |
|
|
|
||
|
|
|
600 |
40 |
|
|
500 |
|
|
|
|
30 |
D |
E |
400 |
|
|
||
20 |
|
|
300 |
|
|
|
|
|
|
|
200 |
10 |
|
|
100 |
B |
C |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 M H2O |
0 |
1 |
2 |
3 |
M NH3 |
|||||||||||||||||||
CuSO4 |
CuSO4·H2O |
|
|
|
CuSO4·3H2O CuSO4·5H2O |
AgCl |
AgCl·NH3 |
2AgCl·3NH3 |
AgCl·3NH3 |
||||||||||||||||||||
Рис. 6.3. Изотерма давления пара в сис- |
Рис. 6.4. Изотерма давления пара в |
||||||||||||||||||||||||||||
|
теме СuSО4 - Н2О при 50°С |
|
|
системе AgCl -NH3 при 16°С |
|||||||||||||||||||||||||
|
|
Рассмотренные до сих пор диаграммы были изотермическими. Анало- |
|||||||||||||||||||||||||||
гично можно построить изобарические диаграммы. В этом случае на оси ординат откладывают температуры, при которых давление диссоциации становится равным постоянному давлению.
На рис. 6.5 изображена такая изобарическая диаграмма для системы PbO - CO2 при атмосферном давлении.
В данной системе возможны следующие реакции:
(при 274°С) 8PbCO3 = 3РbО·5РbСО3 + 3CO2, |
(6.8) |
(при 286°С) 3РbО·5РbСО3 = 4РbО·РbСО3 + СО2, |
(6.9) |
(при 360°С) 3(РbО·РbСО3) = 2(2РbО·РbСО3) + СО2, |
(6.10) |
(при 412°С) 2РbО·РbСО3 = 3РbО + СО2. |
(6.11) |
Рассмотрим теперь случай, когда газ поглощается твердым веществом, причем образуется химическое соединение. На рис. 6.6 изображена изотермическая диаграмма этого случая: кривая АВ отвечает области адсорбции, а прямая ВС - образованию соединения.
7. Конденсированные системы. Методы изучения конденсированных систем
Система называется конденсированной, если парциальным давлением компонентов в изучаемом интервале температур можно пренебречь.
В таких системах рассматриваются равновесия без участия (учета) парообразной фазы. Без большой погрешности можно считать, что давление в системе при изменениях температуры остается постоянным, равным внешнему давлению.

62
t, °C
D
400
C
300 |
A |
B |
|
|
|
200 |
|
|
100
0
1.0 1.2 1.4 1.6 1.8 2.0 2.2 2.4 2.6 2.8 3.0 3.2 3.4 M PbO
PbO·CO28PbO·5CO22PbO·CO2 3PbO·CO2
P
B C
A |
Составтвердойфазы |
Рис. 6.5. Изобарическая диаграмма системы |
Рис. 6.6. Изотерма давления пара |
РbО - СО2 при атмосферном давлении |
двойной системы с образованием |
|
химического соединения при проте- |
|
кании процесса адсорбции |
Для изображения таких систем достаточно на отрезке прямой АВ, называемой осью состава, или осью концентраций, отложить содержание компонента В во взятых смесях в соответствующем масштабе; из полученных точек восстанавливают перпендикуляры и на них откладывают величины температур фазовых превращений. Получив достаточное количество точек для смесей с различным составом, соединяют соответствующие точки линиями, которые в своей совокупности образуют диаграмму состояния.
Основными методами изучения конденсированных систем являются: термический анализ, растворимости, микроструктуры. Применяются также методы рентгенофазного анализа, измерения электропроводности, магнитной проницаемости, электронография и др.
7.1. Термический анализ
Термический анализ является одним из основных методов физикохимического анализа, который в настоящее время превратился в высокочувствительный и совершенный метод фазового анализа простых и сложных систем, основанный на тепловых эффектах протекающих в системе фазовых превращений. При осуществлении этого метода широкое применение получило построение кривых нагревания и охлаждения.
Если какую-то реакционную смесь медленно нагревать или охлаждать и записывать изменение температуры во времени, то фазовые превращения в системе будут нарушать плавный ход кривых нагревания или охлаждения. На них
63
будут наблюдаться остановки или изломы вследствие выделения теплоты кристаллизации или превращения.
Запись этих кривых в настоящее время производится исключительно при помощи саморегистрирующих приборов. Кроме регистрации температуры, широко используется запись разности температур исследуемого образца и эталона - вещества, не имеющего фазовых превращений в изучаемом интервале температур и обладающего теплопроводностью, близкой к теплопроводности исследуемой смеси. Этот метод получил название дифференциальнотермического анализа, он позволяет четко фиксировать температуры начала и конца фазовых превращений, вычислять термохимические характеристики системы.
В некоторых случаях температуры начала кристаллизации можно зафиксировать визуально. Такой метод исследований получил в нашей стране название визуально-политермического. Возможность применения этого метода весьма ограничена. Он не может применяться к непрозрачным и сильноокрашенным системам. Недостатком метода является и его субъективность. Достаточно большое распространение визуально-политермический метод получил благодаря своей простоте.
Укажем еще на так называемый статический метод, или метод закалки, который заключается в следующем: исследуемый образец выдерживают достаточное время при постоянной температуре до наступления равновесия. Затем его подвергают закалке, т.е. очень быстрому охлаждению с целью зафиксировать кристаллическое состояние системы при заданной температуре, и затем исследуют структуру сплавов. Статический метод применяется при исследовании систем с плохо кристаллизующимися расплавами, а также для систем с высокотемпературными равновесиями между твердыми фазами.
7.2. Метод растворимости.
Исторически именно метод растворимости положил начало исследованиям равновесий жидких и твердых фаз. Уже средневековые алхимики знали о том, что в данном количестве воды при данной температуре растворимость соли ограничена и обыкновенно возрастает при нагревании. Из этих наблюдений возникло понятие о насыщенном растворе.
Классическими методами определения равновесных составов жидких и твердых фаз в водно-солевых системах при изобарно-изотермических условиях являются метод остатков Схрейнемакерса и аналитический метод, основанные на количественных определениях содержащихся в насыщенных растворах ионов. Метод остатков отличается от аналитического метода тем, что сочетает аналитические и графические способы получения экспериментальных данных и базируется на теории гетерогенных равновесий.
К изотермическим методам определения растворимости солей относится метод сечений, разработанный Р.В. Мерцлиным. Сущность метода сечений состоит в том, что при заданной температуре после установления равновесия в
64
исходных реакционных смесях определяется какое-либо легко измеряемое свойство жидкой фазы и строится функциональная зависимость этого свойства от состава исходных реакционных смесей, располагающихся в определенном порядке по изменению концентрации компонентов - в определенных сечениях. Точки излома функциональной зависимости указывают на границы фазовых областей системы.
К преимуществам метода сечений можно отнести следующее: корреляцию изотермы физического свойства с изотермой растворимости; возможность идентификации твердой фазы сопоставлением физических свойств этой фазы и чистых компонентов; возможность определения координат точек, лежащих не только на изотерме растворимости, но и на предельных нодах.
Визуально-политермический метод определения растворимости в водносолевых системах является наименее точным по сравнению с методами, описанными выше. Этот метод основан на фиксировании изменения какого-либо физического свойства системы при непрерывном изменении температуры. Такими свойствами могут быть появление кристаллов, изменение вязкости, объема и др. Состав системы всегда задан, это исключает необходимость применения аналитических методов. В случаях, когда нельзя достигнуть четкого фиксирования изменения физических свойств системы, метод не применим.
7.3. Метод микроструктуры
Термический анализ при изучении фазовых превращений дает возможность установить изменение температур нонвариантных и моновариантных равновесий в системах в зависимости от состава. Для распознавания фаз наиболее простым и доступным методом является метод микроструктуры.
Под микроскопом наблюдают микроструктуры сплавов в отраженном или проходящем свете в зависимости от природы изучаемых систем. Если они непрозрачны, наблюдения производят в отраженном свете с помощью металлографического микроскопа. Для этого исследуемый образец отжигают, т.е. выдерживают длительное время, от нескольких часов до многих месяцев, при соответствующей температуре для установления равновесия в системе.
По истечении установленного времени сплавы закаляют - быстро охлаждают, чтобы сохранить их структуру, отвечающую температуре отжига. Закаленные образцы с различными количественными отношениями исходных компонентов подвергают шлифовке и травлению.
Травление производят жидкостью, медленно разъедающей сплав, причем кристаллы разного вида должны разъедаться в разной степени. На шлифе образуется некоторый рельеф, что дает возможность более четко различить фазы системы.
Проведя таким образом отжиг сплавов при различных температурах для ряда смесей, от чистого компонента А до чистого компонента В, и исследуя их, как сказано выше, устанавливают число фаз в системе, их природу в зависимости от температуры отжига и состава.
65
Если исследуемые вещества прозрачны, то микроскопические исследования проводят в проходящем свете, для чего при соблюдении необходимых предосторожностей готовят тонкие прозрачные шлифы.
Если имеют дело с низкоплавкими веществами, то для исследования под микроскопом небольшое количество вещества расплавляют на предметном стекле и дают ему застыть. Приспособив к микроскопу нагревательный столик, можно наблюдать за процессом кристаллизации и фиксировать происходящие изменения в структуре выпавших кристаллов.
Наблюдаемые под микроскопом структуры фотографируют, а процессы образования и изменения их иногда подвергают киносъемке. Для идентификации зерен, видимых под микроскопом, иммерсионным методом определяют их оптические свойства (чаще всего показатель преломления) и микротвердость, т.е. твердость отдельных зерен.
8. Двойные водно-солевые системы
Одной из главных особенностей систем соль - вода является практическое отсутствие твердых растворов на основе льда (исключение составляет фторид аммония) и твердых растворов воды в солях или гидратах. Поскольку при атмосферном давлении водные растворы солей не расслаиваются на две жидкие фазы, диаграммы растворимости в этом случае могут быть представлены тремя простейшими типами (рис. 8.1, 8.3, 8.5).
Система NH4Cl - H2O (рис. 8.1) относится к диаграммам первого типа, в которых кристаллизуется безводная соль, не образующая кристаллогидратов.
Буквами V, L, S обозначены соответственно парообразное, жидкое и твердое фазовые состояния. Применение правила фаз к двухкомпонентной системе, изучаемой при постоянном давлении, показывает, что нонвариантным является равновесие трех фаз, моновариантным - двух фаз и дивариантными являются однофазные системы. Применительно к двойным водно-солевым системам первого типа равновесия парообразной фазы, кристаллов соли и предельно насыщенного раствора (М), а также кристаллов льда, соли и эвтектического раствора (Е) являются нонвариантными. Эти равновесия отображаются на рис. 8.1 предельными нодами (конодами), проходящими через точки М и Е, параллельными оси состава.
Двухфазные равновесия системы: кристаллы льда и раствор (лед + L); кристаллы соли и раствор (NH4Cl(S)+L); раствор и пар (L+H2O(V)) имеют одну фазу переменного состава (L), являются моновариантными и отображаются на диаграмме состояния линиями: плавления льда - от температуры плавления воды до точки Е; растворимости соли - ЕМ; кривая кипения - от температуры кипения воды до точки М. Равновесия кристаллов соли и водяного пара (NH4Cl(S) + H2O(V)), а также кристаллов воды и соли не имеют фазы переменного состава, представлены нодами, проходящими между составами воды и соли при соответствующих температурах.
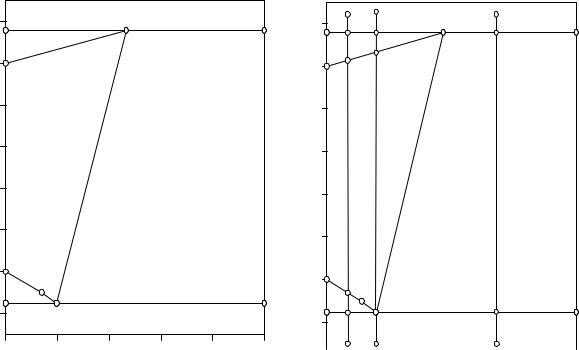
66
t,°C |
|
|
t,°C |
|
|
|
120 |
M H2O(V)+NH4Cl(S) |
120 |
F |
G |
M |
H |
|
|
|
||||
L+H O |
|
|
1 |
6 |
|
9 |
2 (V) |
|
|
|
|||
100 |
|
100 |
2 |
7 |
|
|
|
|
|
|
|
|
80 |
|
80 |
|
|
|
|
60 |
L |
60 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
||
40 |
|
40 |
|
|
|
|
|
|
|
|
|
||
20 |
L+NH4Cl(S) |
20 |
|
|
|
|
|
|
|
|
|||
0 |
|
0 |
|
|
|
|
L+лед |
E |
|
|
|
||
|
3 |
|
|
|||
-20 |
|
|
|
|
||
Лед+NH4Cl(S) |
-20 |
4 |
E |
10 |
||
|
0 |
20 |
40 |
60 |
80 |
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
5 |
820 |
40 |
60 11 |
80 |
100 |
|||||||||||||
H2O |
|
% мас. |
|
NH4Cl |
|||||||||||||||
|
|
H2O |
|
|
|
|
% мас. |
|
|
NH4Cl |
|||||||||
M: M(L)+NH4Cl(s)+H2O(V) |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
E: E(L)+NH4Cl(S)+лед |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Рис. 8.1. Изобара растворимости систе- |
Рис. 8.2. К пояснениям о изменении соста- |
||||||||||||||||||
мы NH4Cl - H2O при атмосферном дав- |
вов равновесных фаз в процессе охлажде- |
||||||||||||||||||
|
|
лении |
|
|
|
|
|
ния различных исходных смесей |
|||||||||||
На диаграмме имеется только одна дивариантная однофазная область - область ненасыщенных растворов (L), отграниченная от других фазовых областей линиями плавления льда, растворимости соли и кипения растворов. Если взять смесь, фигуративная точка которой находится в этой области ненасыщенных растворов, установить равновесие в системе, то исходная смесь будет представлять собой однофазную жидкую систему - ненасыщенный раствор, состав которого равен составу исходной смеси.
Если фигуративная точка исходной смеси окажется в одном из полей моновариантных равновесий (L+S; L+V), имеющих фазу переменного состава - насыщенный раствор, то равновесный состав раствора может быть определен графически, для чего через фигуративную точку исходной смеси проводят ноду от фазы постоянного состава до пересечения с соответствующей линией моновариантных равновесий. Соотношение фаз определяется по правилу рычага.
Кроме того фигуративная точка может также оказаться на одной из предельных нод нонвариантного трехфазного равновесия. В этом случае составы всех фаз, на которые распадется исходная смесь, известны. На ноде, проходящей через точку М, это будут водяной пар, кристаллический безводный хлорид аммония и предельно (при данном давлении) насыщенный раствор состава М. На ноде, проходящей через точку Е, в равновесии будут находиться кристаллы
67
льда, хлорида аммония и эвтектический раствор состава Е.
На рис. 8.2 рассмотрим, как будет протекать изменение составов равновесных фаз при охлаждении различных реакционных смесей. Исходная смесь, состав и состояние которой отображается фигуративной точкой F (рис. 8.2), находится в поле совместного существования водяного пара и кристаллов хлорида аммония. При охлаждении до температуры кипения предельно насыщенного раствора М (точка 1) начнется конденсация пара, растворение кристаллов хлорида аммония и образуется предельно насыщенный при данном давлении раствор М. В это время в равновесии находятся три фазы: пар, раствор М и кристаллы хлорида аммония.
Если отводить тепло от системы, то соотношение равновесных фаз изменяется - количества твердой и парообразной фаз уменьшаются, а количество жидкой фазы М возрастает. Поскольку в исходной смеси содержание хлорида аммония меньше, чем в точке М, постольку кристаллический хлорид аммония кончится быстрее, чем парообразная фаза. В этот момент в равновесии находятся уже две фазы, температура вновь начинает уменьшаться.
При дальнейшем уменьшении температуры состав жидкой фазы изменяется по кривой кипения от точки М до точки 2, состав парообразной фазы остается неизменным, твердая фаза отсутствует. Изменяется и соотношение парообразной и жидкой фаз - уменьшается количество первой и увеличивается количество второй. Когда состав раствора достигнет точки 2, исчезнет парообразная фаза.
На участке охлаждения от точки 2 до точки 3 происходит охлаждение ненасыщенного раствора, состав которого равен составу выбранного сечения. В точке 3 начнется выделение первых кристаллов льда. Равновесие в системе вновь становится моновариантным. Состав жидкой фазы при этом меняется по кривой плавления льда от точки 3 до точки Е, состав твердой фазы отвечает воде. Количество жидкой фазы уменьшается, а твердой - возрастает.
Когда состояние исходной смеси будет соответствовать точке 4, равновесие в системе вновь станет нонвариантным из-за начавшейся кристаллизации хлорида аммония. Составы жидкой и твердых фаз при этом остаются постоянными, состав жидкой фазы равен Е. Соотношение твердых фаз меняется, суммарный состав выпавших кристаллов уходит из состава воды и приходит в состав точки 4, в этот момент исчезает последняя капля жидкой фазы. В системе остаются две твердые фазы: лед и хлорид аммония, она становится моновариантной, вновь начинает уменьшаться температура.
На участке охлаждения от точки 4 до точки 5 происходит уменьшение температуры смеси кристаллов льда и хлорида аммония, суммарный состав выпавших кристаллов остается равным составу выбранного сечения. Жидкая фаза отсутствует, а парциальное давление паров воды гораздо меньше атмосферного и им можно пренебречь.
Политермическое сечение G проходит через эвтектику системы Е. На начальном участке, от точки G до точки 7, протекающие в системе фазовые
68
превращения тождественны описанным выше процессам, протекавшим при охлаждении смеси F от точки F до точки 2 (исключая конечный состав раствора в момент исчезновения парообразной фазы, который будет равен составу точки
7).
На участке охлаждения от точки 7 до точки Е реакционной смеси G система также станет конденсированной, будет происходить охлаждение ненасыщенного раствора, но в точке Е начнется кристаллизация сразу эвтектической смеси кристаллов льда и хлорида аммония. Суммарный состав выпавших кристаллов сразу будет равен составу выбранного сечения. После исчезновения жидкой фазы на участке охлаждения от точки Е до точки 8 также будет происходить охлаждение смеси кристаллов льда и хлорида аммония.
Всоставе исходной смеси Н содержится больше хлорида аммония, чем в точке М. Поэтому при температуре нонвариантного процесса точки М исчезнет не твердая фаза, а парообразная. При дальнейшем охлаждении исходной смеси от точки 9 до точки 10 в равновесии будут находиться кристаллы хлорида аммония и насыщенный раствор, состав которого при этом будет меняться по кривой растворимости соли от точки М до точки Е. Изменится и соотношение твердой и жидкой фаз. Количество твердой фазы будет возрастать.
Вточке 10 система становится нонвариантной. В равновесии находятся кристаллы льда, хлорида аммония и жидкая фаза состава Е. Суммарный состав твердой фазы меняется от состава хлорида аммония до состава выбранного сечения.
На участке охлаждения от точки 10 до точки 11 происходит охлаждение смеси кристаллов льда и хлорида аммония. Жидкая и парообразная фазы отсутствуют. Суммарный состав твердой фазы равен составу выбранного сечения.
Эвтектическая точка (в переводе с греческого "хорошо плавящийся"), как мы видели, обладает рядом уникальных свойств. Она представляет собой жидкую фазу с минимальной температурой, имеет постоянный состав, из нее кристаллизуется твердая фаза того же состава, что и раствор. Последнее делает
еепохожей на чистое химическое вещество, которое при плавлении или кристаллизации имеет жидкую фазу того же состава, что и оно само. Этот факт послужил исторической причиной сложившегося названия эвтектических смесей как "криогидратов", которое вначале означало "гидрат с минимальной температурой плавления".
Смеси солей и льда для получения искусственного холода известны с начала XVII в. Название "криогидраты" появилось в 1875 г. в работе Гётри. В 1895 г. А.Я. Богородский и А. Понсо при исследовании эвтектик окрашенных солей нашли, что они состоят из весьма тонкой смеси бесцветных кристаллов льда и окрашенных кристаллов соли. Окончательную точку в споре о природе эвтектик положили рентгенографические исследования, безусловно доказавшие, что эвтектики являются механической смесью кристаллов.
На рис. 8.3 приведена диаграмма состояния двойной водно-солевой системы LiNO3 - H2O с образованием конгруэнтно растворимого кристаллогидрата

|
|
|
|
|
69 |
|
|
|
|
|
|
|
|
|
состава LiNO3·3H2O, а на рис. 8.4 - наиболее интересные политермические раз- |
||||||||||||||
резы данной системы. |
|
|
|
|
|
|
|
|
|
|
|
|
||
t,°C |
|
|
|
|
t,°C |
|
|
|
|
|
|
|
|
|
220 |
|
H2O(V)+LiNO3(S) |
|
220 |
|
A |
B |
D |
F |
|
|
|
C |
|
200 |
|
|
200 |
|
|
|
|
|||||||
|
|
M |
|
1 |
|
6 |
12 |
17 |
|
|
M 9 |
|||
180 |
L+H2O(V) |
|
180 |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
160 |
|
|
|
|
|
|
18 |
|
|
|
|
|||
|
|
|
|
160 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
140 |
|
|
|
|
140 |
|
|
|
13 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
120 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
100 |
|
|
|
|
120 |
2 |
|
|
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
LiNO3(S)+L |
100 |
|
|
|
|
|
|
|
|
|||
80 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
80 |
|
|
|
|
|
|
|
|
|
40 |
|
E2 |
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
40 |
|
|
|
|
19 E2 |
|
|
|
|
0 |
|
LiNO3(S)+ LiNO3·3H2O(S) |
|
|
|
|
|
|
|
|
||||
E1 |
20 |
|
|
|
14 |
|
|
|
10 |
|||||
|
LiNO3·3H2O(S)+L |
|
|
|
|
|
|
|
|
|
|
|||
-20 |
H2O(S)+L |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
-40 |
H2O(S)+LiNO3·3H2O(S) |
|
|
3 |
E1 |
|
|
|
|
|
|
|||
|
LiNO 3·3H |
2O |
|
-20 |
15 |
|
|
|
|
|
||||
0 |
25 |
100 |
|
|
|
|
|
|
|
|||||
50 |
75 |
|
4 |
|
|
|
|
|
|
|
|
|||
H2O |
|
|
LiNO3 |
|
|
|
|
|
|
|
|
|
||
|
|
-40 |
5 |
|
8 |
16 |
LiNO |
|
·3H |
O |
11 |
|||
M: M(L)+LiNO3(S)+H2O(V) |
|
|
|
|
|
|||||||||
|
|
|
0 |
|
25 |
|
50 |
3 |
|
2 75 |
100 |
|||
E1: E1(L)+LiNO3·3H2O(S)+H2O(S) |
|
|
|
H2O |
|
|
|
|
|
|
|
LiNO3 |
||
E2: E2(L)+LiNO3·3H2O(S)+LiNO3(S) |
|
|
|
|
|
|
|
|
|
|
|
|||
Рис. 8.3. Изобара растворимости двойной |
Рис. 8.4. Некоторые политермические се- |
|||||||||||||
системы LiNO3 - H2O при атмосферном |
чения системы LiNO3 - H2O при атмосфер- |
|||||||||||||
|
|
давлении |
|
|
|
|
|
ном давлении |
|
|
||||
Применение правила фаз к двухкомпонентной системе с образованием конгруэнтно плавящегося кристаллогидрата, изучаемой при постоянном давлении, показывает, что нонвариантным является равновесие трех фаз (парообразной фазы, кристаллов безводной соли и предельно насыщенного раствора (М), кристаллов льда, кристаллогидрата и эвтектического раствора Е1, кристаллов безводной соли, кристаллогидрата и эвтектического раствора Е2). Эти равновесия отображаются на рис. 8.3 предельными нодами, проходящими через точки М, Е1 и Е2, параллельными оси состава.
Двухфазные равновесия системы: кристаллы льда и раствор (H2O(S) +L); кристаллы безводной соли и раствор (LiNO3(S)+L); кристаллогидрат и раствор (LiNO3·3H2O (S)+L); раствор и пар (L+H2O(V)) имеют одну фазу переменного состава (L), являются моновариантными и отображаются на диаграмме состояния линиями: плавления льда - от температуры плавления воды до точки Е1; растворимости безводной соли - Е2М; растворимости кристаллогидрата - Е1Е2; кривая кипения - от температуры кипения воды до точки М. Равновесия кристаллов
безводной соли и водяного пара (LiNO3(S) + H2O(V)), кристаллов воды и кристаллогидрата (LiNO3·3H2O(S) + H2O(S)), кристаллов безводной соли и кристаллогид-
рата (LiNO3·3H2O(S) + LiNO3(S)) не имеют фазы переменного состава, представ-
70
лены нодами, проходящими между составами соответствующих фаз при заданных температурах.
На диаграмме имеется также только одна дивариантная однофазная область - область ненасыщенных растворов (L), отграниченная от других фазовых областей линиями плавления льда, растворимости криталлогидрата, безводной соли и кипения растворов. Если взять смесь, фигуративная точка которой находится в этой области ненасыщенных растворов, установить равновесие в системе, то исходная смесь будет представлять собой однофазную жидкую систему - ненасыщенный раствор, состав которого равен составу исходной смеси.
Если фигуративная точка исходной смеси окажется в одном из полей моновариантных равновесий (L + S; L + V), имеющих фазу переменного состава - насыщенный раствор, то равновесный состав раствора также может быть определен графически, для чего через фигуративную точку исходной смеси следует провести ноду от фазы постоянного состава до пересечения с соответствующей линией моновариантного равновесия. Соотношение фаз определяется по правилу рычага.
При помощи рис. 8.4 рассмотрим, как будет протекать изменение составов равновесных фаз при охлаждении различных реакционных смесей. Исходная смесь, состав и состояние которой отображается фигуративной точкой A (рис. 8.4), находится в поле совместного существования водяного пара и кристаллов нитрата лития. При охлаждении до температуры кипения предельно насыщенного раствора М (точка 1) начнется конденсация пара, растворение кристаллов нитрата лития и образуется предельно насыщенный при данном давлении раствор М. В это время в равновесии находятся три фазы: пар, раствор М и кристаллы нитрата лития.
Если отводить тепло от системы, то соотношение равновесных фаз изменяется - количества твердой и парообразной фаз уменьшаются, а количество жидкой фазы М возрастает. Поскольку в исходной смеси содержание нитрата лития меньше, чем в точке М, постольку кристаллический нитрат лития кончится быстрее, чем парообразная фаза. В этот момент в равновесии находятся уже две фазы, температура вновь начинает уменьшаться.
При дальнейшем снижении температуры состав жидкой фазы изменяется по кривой кипения от точки М до точки 2, состав парообразной фазы остается неизменным, твердая фаза отсутствует. Изменяется и соотношение парообразной и жидкой фаз - уменьшается количество первой и увеличивается количество второй. Когда состав раствора достигнет точки 2, исчезнет парообразная фаза.
На участке охлаждения от точки 2 до точки 3 происходит охлаждение ненасыщенного раствора, состав которого равен составу выбранного сечения. В точке 3 начнется выделение первых кристаллов льда. Равновесие в системе вновь становится моновариантным. Состав жидкой фазы при этом меняется по кривой плавления льда от точки 3 до точки Е1, состав твердой фазы отвечает воде. Количество жидкой фазы уменьшается, а твердой - возрастает.
