
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 1. 1999г
..pdf
131
пересечения ноды со стороной треугольника и даст состав равновесной смеси кристаллов А и В.
Точка Е является тройной эвтектикой системы. При отводе тепла будет происходить нонвариантный (при постоянном давлении) процесс кристаллизации сразу трех твердых фаз. На кривой охлаждения наблюдается температурная задержка (точки 2-3 на кривой F). Состав жидкой фазы остается постоянным, равным Е. Суммарный состав выделившейся твердой фазы изменяется приблизительно от точки еII до точки F. Когда суммарный состав твердой фазы становится равным составу исходной реакционной смеси, исчезает последняя капля эвтектического расплава.
|
|
|
|
Tl2SO4 |
|
|
|
|
|
|
|
|
600 |
600°С |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
550 |
|
550 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
500 |
|
|
500 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
450 |
Tl2SO4 |
|
450 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
400 |
|
|
|
|
|
400 |
|
|
|
350 |
|
|
|
|
|
350 |
|
|
TlNO3 |
300 |
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
400°С |
|||
|
|
|
|
|
|
|
|||
250 |
|
|
250 |
|
|
|
|||
|
|
TlCl |
|
|
|
||||
|
200 |
E 200 |
|
|
|
|
|||
0 |
200 20200 |
250 40 |
300 |
60 |
350 |
80 |
400 |
100 |
|
Tl2(NO3)2 |
|
|
% мол. |
|
|
Tl2Cl2 |
|||
Рис. 14. 3. Система TlNO3 - TlCl - Tl2SO4
Состав исходной реакционной смеси G находится на предельной ноде ВЕ. Особенностью кристаллизации данного расплава, а также любой другой исходной смеси, лежащей на предельной ноде (АЕ, СЕ или ВЕ), является тот факт, что после первичной сразу начинается третичная кристаллизация. В процессе первичной кристаллизации расплава G состав жидкой фазы изменяется по лучу ВЕ от точки G до точки Е. Суммарный состав твердой фазы при этом равен В.
При третичной кристаллизации расплава G состав жидкой фазы остается постоянным, равным Е, составы трех кристаллизующихся твердых фаз также неизменны, а суммарный состав твердой фазы меняется по лучу ВЕ от точки В до точки G.

132
Исходная реакционная смесь, отвечающая составу тройной эвтектики (точка Е), является единственным расплавом, при охлаждении которого отсутствует и первичная, и вторичная кристаллизация, а сразу начинается третичная кристаллизация (точки 1-2 на кривой E).
На рис. 14. 3 приведена диаграмма состояния системы совместно с изотермическими линиями.
14. 3. Политермические разрезы тройной системы простого эвтектического типа
Политермическими разрезами являются сечения пространственной диаграммы состояния вертикальными плоскостями. Проекции этих сечений на плоской диаграмме получаются в виде прямолинейных отрезков, которые также называются разрезами или сечениями.
Прежде всего рассмотрим разрез D-F (см. рис. 14.4), параллельный стороне АВ треугольника состава и проходящий между ней и тройной эвтектикой системы. На левой части рисунка мы видим, что данный разрез пересекает вспомогательные линии АЕ и ВЕ в точках 1 и 3, а также линию двойного выделения в точке 2. На правой части рисунка (собственно политермическом разрезе) на концентрационном отрезке отложено содержание смесей D и F во всех получившихся характеристических точках. На вертикалях отложены температуры фазовых превращений.
L+A+C L+B+C
C |
T |
1 |
2 |
3 |
T |
||
|
TDI |
|
|
L |
|
|
TFI |
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
|||
|
eI |
eIII |
II |
L + A |
L + B |
|
TFII |
||||
|
|
TD |
|
||
|
|
E |
|
|
L + A + B |
|
|
TE |
|
TE |
|
D |
1 |
3 |
|
||
F |
|
|
|||
|
|
2 |
|
|
A + B + C |
|
|
|
|
|
A |
eII |
B D |
F |
Рис. 14. 4. Политермический разрез D-F
В исходном расплаве D температура первичного выделения (TDI) выше, чем температура вторичного (TDII) выделения. В точке 2 эти температуры совпадают (узловая точка первичных и вторичных выделений). По мере изменения содержания компонента В от точки D до точки 2 температура первичной кристаллизации компонента А плавно уменьшается, от точки 2 до точки F темпера-

133
тура первичного выделения плавно же возрастает, но кристаллизуется компонент В.
Точки 1 и 3 являются узловыми для границ вторичных выделений и третичной кристаллизации в политермическом разрезе. От точки D до точки 1 температура вторичного выделения уменьшается от TDII до ТЕ, кристаллизуется при этом смесь компонентов А и С. От точки 1 до точки 2 температура начала вторичного выделения увеличивается, кристаллизуется при этом смесь компонентов А и В. От точки 2 до точки 3 также протекает совместная кристаллизация компонентов А и В, температура начала вторичного выделения снижается до эвтектической. От точки 3 до точки F происходит вторичная кристаллизация компонентов В и С, температура начала вторичного выделения по мере увеличения содержания компонента В в исходной смеси возрастает до температуры вторичного выделения исходной смеси F (TFII).
Третичное выделение всех компонентов системы происходит на всем протяжении разреза при температуре ТЕ. Ниже этой температуры жидкая фаза отсутствует. Предельная нода ТЕ-ТЕ является линией солидуса.
На рис.14. 5 изображен политермический разрез G-H, проходящий параллельно стороне АВ между тройной и двойными эвтектиками системы. В разрезе также имеется три характеристические точки. Точки 1 и 3 находятся на линиях вторичных выделений, а точка 2 - на вспомогательной линии СЕ.
C T T
1 2 3
eI |
|
|
L+A |
L+C |
|
|
|
L+B |
|
||
|
2 |
|
L |
|
|
G |
|
eIII |
|
|
|
1 E |
3 |
H |
|
|
|
|
TE L+A+C |
L+B+C |
TE |
A+B+C
A |
eII |
B G |
H |
Рис. 14. 5. Политермический разрез G-H Политермический разрез A-M (см. рис. 14.6) исходит из вершины, отве-
чающей чистому компоненту А, проходит на сторону СВ треугольника состава и пересекает линию вторичных выделений еIE (точка 1), а также вспомогательную линию СЕ (точка 2). Для проверки правильности построения политермического разреза воспользуемся для примера текущим составом Х.
Исходная смесь Х находится в поле кристаллизации компонента С, внутри кривостороннего треугольника СеIE. Данный расплав должен иметь

134
первичное выделение С (температура ТХ), вторичное выделение компонентов А и С(температура ТX') и третичное выделение всех трех компонентов при температуре тройной эвтектики. И в политермическом разрезе, правая часть рисунка, вертикаль Х пересекает эти же фазовые области. Причем температура первичного выделения должна быть ниже температуры первичного выделения сплава 2, но выше температуры начала кристаллизации сплава 1. Температура начала вторичного выделения сплава Х (TX') должна быть ниже температуры начала вторичного выделения сплава 1, но выше температуры тройной эвтектики. Все эти факты также соответствуют изображению политермического разреза. Аналогично могут быть проверены и другие части построенного разреза.
|
|
|
|
C |
T |
L+B+C |
T |
||
|
|
|
|
|
TA |
L |
1 |
X 2 |
|
|
|
|
|
|
M |
|
|
|
T2 |
|
|
|
|
|
|
L+A |
|
|
|
e |
|
X |
2 |
T1 |
|
L+C |
TX |
||
|
|
|
|||||||
|
I |
|
|
|
e |
|
|
|
TIII |
|
|
1 |
|
|
III |
L+A+C |
|
|
TX' |
|
|
X' E |
|
|
|
||||
|
|
|
|
|
|
|
TE |
||
|
|
|
|
|
|
A+B+C |
|
|
|
A |
eII |
B A |
|
|
M |
|
|
||||
|
Рис. 14. 6. Политермический разрез A-M |
|
|
|
|
14. 4. Изотермические разрезы тройной системы простого эвтектического типа
Переходя к изучению горизонтальных или изотермических разрезов, используем данные рис. 14. 3 для их построения. Первое изотермическое сечение проведем при температуре, равной 400°С (см. рис. 14. 7). Эта температура ниже точек плавления сульфата и хлорида таллия, но выше температур плавления нитрата таллия и всех эвтектик системы. Разрез пересекает части поверхности солидуса, отвечающие выделению сульфата и хлорида таллия.
На рис. 14. 7 видны две изотермические линии, отделяющие на плоскости концентрационного треугольника два поля гетерогенных равновесий L+Tl2SO4 и L+TlCl от гомогенной жидкофазной области. Для подчеркивания гетерогенного характера в полях кристаллизации компонентов проведены ноды. Пунктирными линиями изображены моновариантные линии системы.
Второй разрез проведем при 300°С. При этой температуре изотермы пересекаются на линии двойного выделения хлорида и сульфата таллия. Возникает трехфазная область совместного существования расплава с кристаллами хло-

135
рида и сульфата таллия. Валовой состав твердой фазы, соотношение твердых и жидкой фазы, а также соотношение каждой из солей в донной фазе можно определить по правилу рычага (точки N, N', O, O').
Третий разрез проведем при 200°С (рис. 14. 9). Он отличается от предыдущего разреза наличием второй трехфазной области (L + Tl2SO4 + TlNO3).
|
|
|
Tl2SO4 |
|
|
|
|
L+Tl2SO4 |
|
|
|
|
|
|
400 |
|
|
400°C |
|
|
|
|
L |
|
|
400°С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
L+TlCl |
0 |
20 |
40 |
60 |
80 |
400 |
100 |
Tl2(NO3)2 |
|
% мол. |
|
Tl2Cl2 |
||
Рис. 14. 7. Изотермический разрез системы Tl2SO4 - TlNO3 - TlCl при 400°С
|
|
|
Tl2SO4 |
|
|
|
|
L+Tl2SO4 |
|
|
|
|
|
|
|
|
|
|
N' L+TlCl+Tl2SO4 |
|
|
|
|
|
N |
|
|
|
300°C |
|
|
300 |
O |
O' |
|
L |
|
|
|
||
|
|
|
|
|
L+TlCl |
|
|
|
|
|
|
|
|
0 |
20 |
40 |
300°C |
60 |
80 |
100 |
Tl2(NO3)2 |
|
% мол. |
|
Tl2Cl2 |
||
Рис. 14. 8. Изотермический разрез системы Tl2SO4 - TlNO3 - TlCl при 300°С

136
14. 5. Оптимальный план изучения тройных систем плавкости простого эвтектического типа
Д.А. Петровым предложен прием, с помощью которого по минимальному числу вертикальных разрезов можно определить положение пограничных кривых и эвтектики. Мы ограничимся изложением метода в применении к системе с простой эвтектикой. Покажем, как находится пограничная кривая еIE.
Экспериментально исследуются политермические разрезы FG и MN на треугольной диаграмме (см. рис. 14.10). Метод основан на том, что составы, примыкающие к точке F, имеют кривую вторичных выделений, общую с составами, примыкающими к точке М во втором разрезе.
|
|
|
Tl2SO4 |
|
|
|
L+Tl2SO4 |
|
|
|
|
|
|
|
|
L+TlCl+Tl2SO4 |
|
L+TlNO3+Tl2SO4 |
|
|
|
|
|
L+TlNO3 |
|
|
|
|
L+TlCl |
|
200 |
|
|
|
|
|
|
|
|
|
|
|
L |
|
|
|
|
0 |
200°C20200°C |
40 |
60 |
80 |
100 |
Tl2(NO3)2 |
|
% мол. |
|
Tl2Cl2 |
|
Рис. 14. 9. Изотермический разрез системы Tl2SO4 - TlNO3 - TlCl при 200°С На общих кривых вторичных выделений интерполяцией эксперимен-
тальных данных находят два состава исходных смесей (точки х1 и х2) с одинаковой температурой начала вторичных выделений(ТХ). Полученные точки наносят на концентрационный треугольник и проводят ноды А-х1 и С-х2 до пересечения друг с другом в точке Х, лежащей на линии вторичных выделений.
Экстраполяцией экспериментальных данных в обоих сечениях находят точки пересечения линий вторичных выделений с солидусом системы (точки y1 и y2). Проводя ноды А-y1 и С-y2 до пересечения друг с другом, находят состав тройной эвтектики системы (точка Е).
Аналогичным путем можно получить любое количество точек на линии вторичных выделений еIЕ. Таким же путем можно получить точки на кривых еIIЕ и еIIIЕ, разделяющие поля кристаллизации компонентов А и В, а также В и
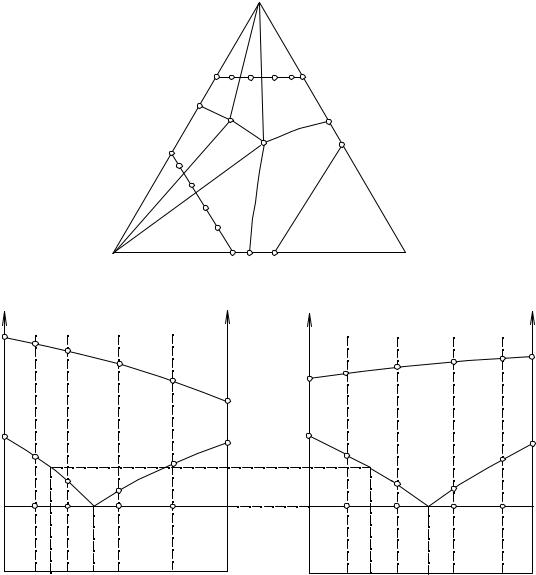
137
С. Для этого нужно изучить лишь еще один аналогичный политермический разрез (RS), лежащий в поле кристаллизации компонента В.
C
eI M 5x62 y72 8 N eIII
F |
1 |
|
X |
E |
S |
|
|
|
|||
|
x 2 |
|
|
|
|
|
1 |
3 |
|
|
|
|
y1 |
4 |
|
|
|
|
|
A |
G eII R |
|
B |
|
|
|
1 |
2 |
L |
3 |
4 |
5 |
6 |
L |
7 |
8 |
|
|
|
|
|
|
|
|
L+A |
|
L+C |
|
|
|
|
|
|
|
|
TX |
TX |
|
|
L+ A+C |
L+A+B TE |
TE L+ A+C |
|
L+B +C |
|
A+B+C |
|
|
A+B+C |
F x1 y1 |
G |
M x2 |
y2 |
N |
Рис. 14. 10. Построение диаграммы плавкости по способу Петрова
138
Словарь физико-химических терминов
Бинодальная кривая - линия, показывающая составы двух равновесных
фаз.
Вариантность системы (равновесия) - число термодинамических степеней свободы.
Всаливание - явление увеличения растворимости какого-либо компонента в присутствии других компонентов системы.
Высаливание - явление уменьшения растворимости какого-либо компонента в присутствии других компонентов системы.
Двойная (бинарная) система - система, состоящая из двух компонен-
тов.
Дивариантное равновесие - фазовое равновесие, число степеней свобо-
ды которого равно двум. Геометрическим образом дивариантного равновесия является поле.
Изобара - фазовая диаграмма или кривая состав-свойство при постоянном давлении.
Изолиния - вспомогательная линия, соединяющая точки с каким-либо одинаковым свойством.
Изологическая линия - вспомогательная прямая линия, проведенная из одной вершины треугольной диаграммы. Вдоль нее сохраняется одинаковое соотношение двух компонентов. К ней могут быть отнесены лучи испарения и кристаллизации.
Изопикна - соединительная линия, связывающая точки составов смесей с одинаковой плотностью.
Изотерма - фазовая диаграмма или кривая состав-свойство при постоянной температуре.
Инконгруэнтное (с разложением) плавление или растворение - про-
цесс плавления или растворения какой-либо твердой фазы, сопровождающийся появлением другой твердой фазы.
Компоненты - индивидуальные химические вещества, взятые в наименьшем количестве, достаточные для построения всей системы, находящейся в состоянии равновесия.
Конгруэнтное (без разложения) плавление или растворение - процесс плавления или растворения какой-либо твердой фазы, при котором состав рас-
139
плава (при конгруэнтном плавлении) тождественен составу твердой фазы, а солевой состав насыщенного раствора (при конгруэнтном растворении) тождественен солевому составу растворяющейся твердой фазы.
Коннода - предельная нода, связывающая составы двух или более фаз, находящихся в нонвариантном равновесии.
Критическая температура - максимальная температура равновесия жидкой и парообразной фазы любого вещества, выше которой исчезает разница между парообразной и жидкой фазой.
Критическая температура растворения - наименьшая температура,
при которой две жидкости смешиваются во всех отношениях, а выше которой происходит расслоение на две жидкие фазы (нижняя критическая температура), или же наибольшая температура, при которой еще существует равновесие двух жидких фаз (верхняя критическая температура).
Метастабильное равновесие - состояние равновесия одной или более фаз, которое является неустойчивым относительно какой-то другой отсутствующей фазы.
Моновариантное равновесие - фазовое равновесие, число степеней свободы которого равно единице. Геометрическим образом моновариантного равновесия является линия.
Монотектическое равновесие - нонвариантное равновесие двух жидких и твердой фазы в двойных конденсированных системах, причем состав твердой фазы находится по одну сторону от равновесных составов жидких фаз
(см. также синтектическое равновесие).
Монотропное превращение - фазовое превращение, самопроизвольно протекающее только в одну сторону - от метастабильной фазы к стабильной.
Нода - прямая соединительная линия, связывающая на диаграмме точки равновесных составов фаз.
Нонвариантное (инвариантное) равновесие - фазовое равновесие, чис-
ло степеней свободы которого равно нолю. Геометрическим образом нонвари-
антного равновесия является точка или предельная нода (коннода).
Перитектика - состав и температура нонвариантного равновесия жидкой и двух или более твердых фаз, причем хотя бы одна из твердых фаз (устойчивая при низких температурах) исчезает, а другая (устойчивая при высоких температурах) образуется при подводе тепла к системе, при отводе тепла от системы протекает обратный процесс.
140
Перитоника - состав раствора, находящегося в нонвариантном равновесии с двумя или более твердыми фазами, причем хотя бы одна из твердых фаз исчезает, а другая образуется в процессе изотермического испарения.
Поле - геометрический образ (кроме точки и линии) на диаграмме, отображающий определенное фазовое равновесие.
Политерма - изображение нескольких изотерм на одной диаграмме, выделение на диаграмме температурной оси и построение на ней функциональной зависимости каких-либо физико-химических свойств от температуры (политерма растворимости - зависимость растворимости какого-либо вещества от температуры).
Разрез - вспомогательная плоскость, на которой располагаются составы исходных реакционных смесей при исследовании четверных, пятерных и т.д. систем.
Сечение - вспомогательная прямая линия, на которой располагаются составы исходных реакционных смесей при исследовании тройных систем.
Синтектическое равновесие - нонвариантное равновесие двух жидких и твердой фазы в двойных конденсированных системах, причем состав твердой фазы находится между равновесными составами жидких фаз (см. также моно-
тектическое равновесие).
Система - группа веществ в состоянии равновесия.
Соединительная линия - прямая вспомогательная линия, связывающая на диаграмме точки определенных составов.
Солевой состав - состав смеси или раствора без растворителя, пересчитанный на 100 %.
Солютропа - соединительная линия, параллельная основанию диаграммы тройной системы.
Термодинамические степени свободы (степени свободы) - независи-
мые параметры системы, находящейся в термодинамическом равновесии, которые могут принимать произвольные значения в определенном интервале, причем равновесные фазы при этом не изменяются ни качественно, ни количественно.
Триангуляция - разбиение системы на подсистемы, которые являются самостоятельными системами.
Тройная система - система, состоящая из трех компонентов.
Фаза - совокупность всех гомогенных частей системы, одинаковых во всех точках по составу и по всем химическим и физическим свойствам и отгра-
