
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 1. 1999г
..pdf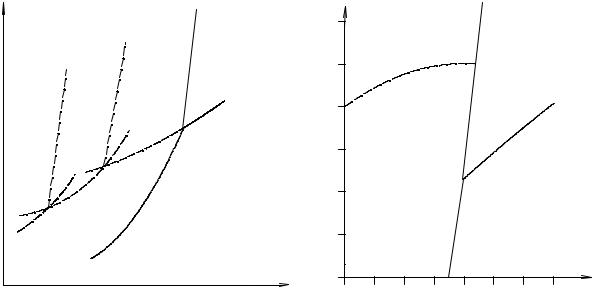
31
ской серы, переохлажденной жидкой серы и пара, пересыщенного относительно равновесного пара моноклинной серы.
Если исходить из переохлажденной жидкой серы, то в первую очередь обычно выкристаллизовывается менее устойчивая модификация, которая уже после достаточной выдержки переходит в более устойчивую модификацию. Эта зависимость представляет собой иллюстрацию правила Оствальда, согласно которому в случае возможности ряда фазовых переходов от менее устойчивых состояний ко все более устойчивым образуется ближайшая устойчивая модификация, а не самая устойчивая.
Бывают случаи, когда кривая давления паров одной кристаллической модификации (кривая возгонки) располагается выше кривой давления другой твердой фазы, тогда полиморфное превращение может идти только в одну сторону. Такие полиморфные превращения называются монотропными.
Примером диаграммы, описывающей реальную монотропную систему, является диаграмма состояния фосфора (см. рис.3.8).
P
S (Pфиолетовый) |
|
|
L |
Белый(I) |
|
Белый(II) |
|
|
D |
C |
|
B |
V |
A |
|
lg P
6 |
|
SАлмаз |
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
K(12000 ат, |
|
4 |
|
|
•7000K) |
|
|
|
|
L |
|
3 |
|
SГрафит |
|
|
2 |
|
A(200ат, 3700°С) |
|
|
|
|
|
|
|
1 |
|
|
V |
|
|
|
|
|
|
0 |
|
|
|
T,K |
T |
0 |
1000 2000 3000 4000 5000 6000 7000 |
||
Рис. 3. 8. Диаграмма состояния фосфора Рис. 3.9. Диаграмма стояния углерода
Диаграмма состояния углерода, приведенная на рис. 3.9, является важной с практической точки зрения.
3.5. Стабильные, метастабильные и лабильные состояния
Та область, в которой данная фаза обладает наибольшей устойчивостью и не претерпевает превращения даже в присутствии других фаз того же вещества, носит название области стабильности.
Если та же фаза в другой фазовой области также устойчива, но при внесении затравки другой фазы того же вещества происходит превращение в более стабильную модификацию, то первая фаза называется метастабильной, а эта область - областью метастабильности.
32
Наконец, если фаза самопроизвольно в отсутствии других фаз превращается в другую фазу, то такая фаза называется лабильной, а область - областью лабильности.
Кинетические закономерности процессов кристаллизации исследованы Тамманом. Тамман показал, что превращение одной фазы в другую может совершаться с самой разнообразной скоростью, но, во всяком случае, оно происходит не сразу во всем объеме фазы, а начинается в определенных точках ее - так называемых центрах образования (зародышах), которые при кристаллизации носят название центров кристаллизации. Скорости процессов кристаллизации слагаются из двух величин: из скорости образования зародышей, которую обозначают буквами ЧЦ (число центров), и скорости отложения вещества на уже образовавшемся зародыше; эту скорость называют линейной скоростью кристаллизации и обозначают сокращенно СК. Тамманом был установлен ряд закономерностей, которым подчиняются процессы кристаллизации. С увеличением степени переохлаждения скорость образования зародышей вначале возрастает, затем достигает максимума, после чего начинает уменьшаться. При очень сильном переохлаждении она становится совсем незначительной. Линейная скорость кристаллизации с понижением температуры вначале также растет, затем в некотором интервале температур остается постоянной, после чего падает.
Условия кристаллизации определяются обеими скоростями; так, если максимум скорости образования зародышей попадает в область больших величин СК, то вещество кристаллизуется легко, и получить переохлажденную жидкость трудно. Если максимум скорости образования зародышей попадает в область температур, при которых СК мала, то жидкость легко переохладить, и можно даже получить вещество в стеклообразном или аморфном состоянии. При малой скорости образования зародышей вещество легко получить в виде более или менее крупных кристаллов; напротив, при большом значении этой скорости структура затвердевшего вещества получается мелкокристаллической.
4.Общие сведения о двухкомпонентных системах
4.1.Способы выражения концентрации
Вдвухкомпонентных (двойных, бинарных) системах становится возможным появление фаз переменного состава: растворы (S и L), газовая фаза (V), имеется второй компонент и возникает вопрос о способе выражения концентрации.
Основными способами выражения концентраций являются:
1. Массовые доли - отношение массы какого-либо вещества к массе всей смеси. Массовые доли, умноженные на 100, дают % мас. Сумма массовых долей равна единице, а % мас. - 100.
2. Мольные доли - отношение числа молей данного вещества к общему числу молей всех веществ в данной смеси. Если умножить мольные доли на

33
100, то получим % моль. Сумма мольных долей смеси равна 1, а % мол. - 100.
ПРИМЕР |
|
Вывести соотношение мольных и массовых долей, если: |
|
xA и xB - массовые доли веществ А и В в смеси; |
|
XA и XB - мольные доли веществ А и В в смеси; |
|
MA и MB - молекулярные массы веществ А и В. |
|
XA = (xA /MA)/( xA/MA + xB/MB ), учитывая хB = 1 - хA , получаем: |
|
XA = MBxA /(MA + (MB -МA)xA), |
(4.1) |
XB = MAxB /(MB + (MA -МB)xB), |
(4.2) |
xA = MAХA /(MB + (MA- МB)ХA), |
(4.3) |
xB = MBХB /(MA + (MB- МA)ХB), |
(4.4) |
Если в системе образуется химическое соединение, то состав его можно выразить двумя способами.
Во-первых, можно указать концентрации смешанных компонентов, считая, что химическое соединение как бы не образуется; заданные таким образом концентрации называются аналитическими.
Во-вторых, можно указать концентрации исходных компонентов и химического соединения в образовавшейся равновесной смеси; определенные таким образом концентрации называются истинными.
Как правило, пользуются аналитическими концентрациями, а истинные концентрации служат для некоторых расчетов.
4.2. Методы изображения двухкомпонентных систем Правило рычага
Состав данной системы очень легко выразить графически. Пусть этот состав выражен в долях. Берем отрезок прямой АВ, равный 1, называемый осью состава (рис.4.1) и откладываем от точки В долю компонента А, получим точку Q, изображающую данный состав; длина отрезка ВQ численно равна доле вещества А, а QА - вещества В.
|
|
|
|
|
Рис. 4.1. Ось состава двойной |
|
A |
Q 2 Q Q 1 |
B |
||||
системы |
||||||
Если состав выражается в % , то длина АВ равна 100 единицам. И если смесь содержит а частей вещества А и в частей вещества В, то ВQ = а, АQ = b и
ВQ + АQ = 100.
Содержание компонентов А и B можно вычислить по формулам:
xA = а/(а+b); |
xB = b/(a+b). |
как координаты центра |
Таким образом, координаты точки Q находят, |
||
тяжести двух масс: a, помещенной в точке А, и b, помещенной в точке В. Поэтому координаты xA и xB называются барицентрическими. То же самое
относится и к мольным долям XA и XB. |
|
Если из q1 г смеси Q1 и q2 г смеси Q2 нужно приготовить q г Q, то |
|
q1/q2 = QQ2/Q1Q, |
(4.5) |
q1/q = QQ2/Q1Q2, |
(4.6) |
q2/q = QQ1/Q1Q2. |
(4.7) |
34
Таким образом, правило рычага можно сформулировать следующим образом: если смешать q1 весовых единиц смеси Q1 и q2 весовых единиц смеси Q2, то точку, изображающую состав полученной смеси Q, можно найти, разделив отрезок Q1Q2 на части QQ2 и Q1Q, обратно пропорциональные количествам взятых смесей. Это правило, называемое также правилом центра тяжести или правилом отрезков, применимо при построении диаграмм только при таком способе выражения концентраций, когда сумма этих концентраций равна постоянной величине.
Диаграмма состав-свойство двойной системы может быть построена на плоскости, при этом по оси абсцисс откладывается содержание компонентов в исследуемых смесях, а по оси ординат - величина физического свойства.
Диаграмма состояния, связывающая состав системы, Р и Т, должна быть объемной, но при построении изотерм или изобар диаграмма вновь может быть изображена на плоскости. Такие изображения значительно удобнее.
5.Жидкие системы
5.1.Идеальные, неидеальные и нормальные системы
Далее часто придется пользоваться понятием об идеальном растворе. Поэтому напомним определение этого понятия и некоторые следствия из него. Рассмотрим раствор, образованный смешением двух жидкостей А и В. Раствор называется идеальным, если в нем силы взаимодействия молекул разных видов равны силам, с которыми действуют друг на друга молекулы одного вида. Следовательно, рассматриваемый нами раствор идеален, если между молекулами веществ А и В действуют такие же по величине силы, какие действуют и между молекулами А или соответственно между молекулами В.
Отсюда следует, что в идеальном растворе молекулы А и молекулы В удерживаются одинаковыми силами, а значит, они будут переходить в пар в количествах, пропорциональных их содержанию в растворе. С другой стороны, парциальное давление газа в газовой смеси пропорционально количеству его молекул, находящихся в этой смеси. Таким образом, для идеального раствора парциальное давление каждого компонента в паре пропорционально его мольной доле в жидкости. Это положение называется обобщенным законом Рауля и может быть выведено из его обычной формы, согласно которой относительное понижение давления пара данного вещества при растворении его в другом равно мольной доле этого второго вещества.
Пусть мольные доли компонентов А и В в жидкой смеси будут XA и XB, парциальное давление их паров - pA и pB; давление паров чистых компонентов А и В будут p°A и p°B. Тогда закон Рауля можно написать в виде формул
(p°A - pA)/p°A = XB, |
(5. 1) |
(p°B -pB)/p°B = XA . |
(5. 2) |
Если числа молей вещества А и В в растворе nA и nB, то мольные доли
35 |
|
равны: |
|
XA = nA/(nA + nB), |
(5. 3) |
XB = nB/(nA + nB). |
(5. 4) |
Подставим значение XB из (5.4) в (5.1.), получим |
|
pA = p°AXA, |
(5. 5) |
pB = p°BXB. |
(5. 6) |
Формулы (5.5) и (5.6) и выражают обобщенный закон Рауля.
Так как между молекулами А и В в идеальном растворе действуют такие же по величине силы, как и между молекулами А или молекулами В, то при смешении веществ А и В не должно происходить ни выделения, ни поглощения энергии, другими словами, смешение этих веществ не сопровождается никаким тепловым эффектом, если образующийся раствор идеален. Наконец, ввиду равенства сил, с которыми действуют друг на друга однородные и разнородные молекулы в идеальном растворе, образование последнего не должно сопровождаться изменением объема системы.
Таким образом, объем образующегося идеального раствора равен сумме объемов взятых компонентов и, следовательно, удельный объем его может быть вычислен по правилу смешения из удельных объемов компонентов, если концентрация идеального раствора выражена в массовых долях (или в % мас.). Если же концентрация задана в мольных долях (или % мол.), то аддитивным является мольный объем раствора.
Идеальные растворы образуются обычно неполярными или малополярными жидкостями со сходным химическим строением и близкими молярными массами. Так, смеси бензола и толуола очень близки к идеальным. То же самое можно сказать о смесях хлорбензола с бромбензолом и т.д. С другой стороны, известны случаи образования растворов, довольно близких к идеальным, и веществами с не очень сходным химическим строением.
Многие авторы работ по физико-химическому анализу понимают идеальную систему в несколько более широком смысле, чем это только что указано. Согласно их представлениям, система идеальна, если в ней не происходит образования химического соединения или диссоциации компонента. Однако другие авторы, учитывая неудобство употребления одного термина для двух различных понятий, предложили последние системы называть нормальными. Мы будем придерживаться этой терминологии и называть систему нормальной, если в ней не образуется химического соединения или не происходит диссоциация компонентов. Идеальной же системой мы будем называть систему, в которой между разнородными молекулами действуют силы той же величины, что и между однородными.
Следует отметить, что всякая идеальная система в то же время является и нормальной, но не наоборот, так как в нормальной системе отклонение от
36
идеальности может вызываться так называемыми ван-дер-ваальсовыми силами.
5.2. Растворимость в двойных жидких системах
При изучении взаимной растворимости жидкостей следует иметь в виду следующие случаи: а) жидкости смешиваются друг с другом во всех отношениях; пример: вода и спирт; б) жидкости совершенно взаимно не растворимы или, как говорят, не смешиваются друг с другом; пример: вода и ртуть; в) жидкости частично растворимы друг в друге; пример: вода и эфир.
Если к воде прибавить небольшими порциями эфир и каждый раз сильно взбалтывать, то сначала эфир растворяется в воде, но скоро раствор станет насыщенным и дальнейшее растворение эфира прекратится. Аналогично этому, если к эфиру при взбалтывании прибавлять воду, то вода сначала будет растворяться, пока раствор не станет насыщенным. Если взболтать друг с другом приблизительно равные объемы воды и эфира, то смесь, постояв, быстро разделяется на два слоя: нижний слой будет насыщенным раствором эфира в воде, а верхний - воды в эфире.
Это можно доказать следующим образом: отделив слои друг от друга, обрабатывают верхний слой безводным сульфатом меди, при этом соль синеет, что служит признаком того, что верхний слой содержит воду; некоторое количество нижнего слоя помещают в большую пробирку, снабженную пробкой с газоотводной трубкой; при нагревании пробирки выходящие из нее пары содержат эфир в таком количестве, что могут быть зажжены.
Явление ограниченной взаимной растворимости жидкостей встречается довольно часто. Строго говоря, сюда же должен быть отнесен случай полной несмешиваемости жидкостей, так как абсолютной нерастворимости, конечно, не существует, и полная несмешиваемость сводится, на самом деле, к чрезвычайно малой взаимной растворимости.
Для изображения растворимости жидкостей и зависимости ее от температуры при постоянном давлении строим диаграмму: валовой состав смеси и отдельных растворов изображаем при помощи отрезка прямой оси состава или концентраций; далее восстанавливаем к оси состава перпендикуляры и откладываем на них соответствующие температуры.
Таким образом, прямые, параллельные оси состава, являются прямыми постоянных температур - изотермами. При таком способе построения все точки нашей диаграммы изображают: для случая "а" - однородные смеси (растворы), а для случая "б" - неоднородные смеси (гетерогенные системы). Несколько сложнее будет диаграмма для случая "в" - ограниченной растворимости жидкостей.
Перейдем к ее изучению, взяв в качестве первого примера систему вода - фенол. Фенол, правда, при обыкновенной температуре - твердое тело, но, вопервых, он очень легкоплавок (температура плавления его 42,5 °С), а, вовторых, что особенно важно, достаточно прибавить к фенолу малейшее количество воды, как он становится жидким и при обыкновенной температуре. Поэтому систему вода - фенол можно рассматривать как типичную систему, образо-

37
ванную частично растворяющимися друг в друге жидкостями. В этой системе наблюдаются явления, сходные с описанными выше и имеющие место в системе вода - эфир.
На рис. 5.1. показана диаграмма растворимости системы вода - фенол. При 20°С два слоя, находящихся в равновесии, содержат 8.2 и 72.1 % мас. фенола. При повышении температуры взаимная растворимость фенола и воды возрастает; поэтому концентрация фенола в первом слое повышается, а во втором - понижается. Так при 25°С концентрации будут (% мас.): 8.45 и 71.05, при
35°С - 9.1 и 68.5.
|
t,°C |
|
|
|
|
|
|
|
t,°C |
|
|
70 |
|
|
K |
|
|
|
|
|
|
|
|
60 |
G |
|
|
|
L |
|
|
|
|
|
|
50 |
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
|
20 |
P |
M |
|
N |
|
O |
|
Q |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Рис. 5.1. Взаимная раство- |
10 |
|
|
|
|
|
|
|
|
|
|
римость в системе фенол - |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
вода |
H2O |
|
|
|
% мас. |
|
|
|
C6H5OH |
|
||
Мы видим, что фигуративные точки растворов, находящихся в равновесии, или, другими словами, сопряженных растворов, при повышении температуры приближаются друг к другу и при некоторой температуре сливаются, т.е. при этой температуре оба слоя становятся тождественными, а система однородной.
Температура, при которой оба сопряженных раствора становятся тождественными, называется критической температурой растворения, или, если это не вызовет недоразумения, просто критической температурой. Фигуративная точка, полученная слиянием двух сопряженных точек при повышении температуры до критической, называется критической. Состав раствора, отвечающего критической точке, называют иногда критическим составом.
Для нашей системы критическая температура 65.85°С, а критический состав - 34 % мас. фенола. Выше критической температуры вода и фенол смешиваются друг с другом во всех отношениях, а ниже - может наступать расслаива-
38
ние, если фигуративная точка системы попадает в область, ограниченную кривой, являющейся совокупностью сопряженных точек. Эта кривая - кривая растворимости, так как она показывает концентрацию сопряженных растворов как функцию температуры. Область, ограниченная этой кривой, называется областью расслаивания или гетерогенности, а находящаяся вне ее - областью гомогенности.
Если фигуративная точка системы попадает в область гетерогенности, то, как мы только что указали, система будет состоять из двух сопряженных растворов, состав которых дается соответствующими точками кривой растворимости. Пусть, например, М - фигуративная точка нашей системы, проводим через нее изотерму PQ; точки пересечения последней P и Q характеризуют составы тех двух сопряженных растворов, на которые расслаивается наша система. Количества этих растворов (mP - масса раствора Р, mQ - масса раствора Q) определяются правилом рычага:
mP = MQ . mQ MP
Раствор P будет представлять собой раствор фенола в воде, а Q - раствор воды в феноле.
При нагревании нашей системы ее фигуративная точка движется по прямой МG от М к G. При этом, как легко можно показать, применяя правило рычага, количество раствора фенола в воде будет возрастать, а воды в феноле - убывать; по достижении точки G второй слой исчезает и остается лишь первый. Наоборот, если нагревать систему, фигуративная точка которой О лежит по другую сторону критической точки К, то исчезнет слой, содержащий раствор фенола в воде. Если, наконец, нагревать систему, фигуративная точка которой N лежит на прямой NК, проходящей через критическую точку К, то по достижении последней сразу исчезнет граница между слоями.
Все эти явления напоминают те, которые наблюдаются при нагревании до критической температуры системы, состоящей из жидкости и ее пара, например из жидкой и газообразной двуокиси углерода, помещенной в запаянной стеклянной трубке. Сходство усиливается еще тем, что при охлаждении раствора критического состава до температуры, лежащей немного выше критической, также наблюдается опалесценция, которая объясняется скоплениями молекул (флюктуация) одного компонента, причем эти скопления то возникают, то исчезают. Эта опалесценция называется критической.
Заслуживает внимания то обстоятельство, что касательная к кривой растворимости, проходящая через критическую точку, параллельна оси состава; таким образом, этой точке отвечает максимальная температура на кривой растворимости.
Критическую точку систем, аналогичных только что описанной, называют верхней критической точкой, так как она отвечает максимальной температуре кривой растворимости и может быть достигнута при нагревании смеси критического состава. Из систем с верхними критическими точками можно на-

39
звать смеси вода - анилин, вода - нитрил янтарной кислоты и многие другие. Существуют и системы с нижней критической точкой, к описанию диа-
грамм которых мы сейчас и переходим. На рис 5.2. изображена диаграмма системы вода - триэтиламин по данным Ротмунда и др.
|
t, °C |
|
|
|
|
|
|
|
t, °C |
|
80 |
|
|
|
|
|
|
|
|
|
|
70 |
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
Рис. 5. 2. Растворимость в сис- |
10 |
|
|
|
|
|
|
|
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 100 |
теме вода - триэтиламин |
H2O |
|
|
|
% мас. |
|
|
|
(C2H5)3N |
|
|
В этой системе растворимость при повышении температуры падает, а при понижении ее возрастает. Поэтому ветви кривой растворимости будут стремиться к сближению и при температуре 18.5°С сходятся. Эта температура и будет критической, а именно нижней критической, так как область расслаивания лежит выше ее и критическая точка достигается при понижении температуры. Мы видим, что нижняя критическая точка является точкой минимума температур на кривой растворимости. Ввиду своеобразного вида этой кривой ( часть ее вблизи критической точки становится почти параллельной оси состава) невозможно точно определить критический состав для данной системы, но наблюдения над критической опалесценцией показывают, что критическая концентрация равна приблизительно 30% триэтиламина. Примерами систем с нижней критической точкой (кроме только что описанной) могут служить: вода - этилпиперидин, вода - коллидин и др.
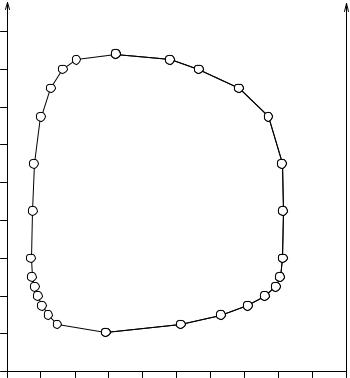
Кроме систем с верхней или нижней критической точкой известны системы с обеими критическими точками, примером которых может служить система вода - никотин; ее диаграмма растворимости, по данным Гудсона (1904), изображена на рис.5. 3. У этих систем кривая растворимости замкнута; область гетерогенности лежит внутри, а гомогенности - вне ее. У системы вода - никотин нижняя критическая точка лежит при температуре 61°С, а верхняя - при
|
|
|
|
|
|
|
|
40 |
|
|
|
208°С. |
|
|
|
|
|
|
|
|
|
|
|
|
t, °C |
|
КВ |
|
|
|
|
|
t, °C |
|
|
220 |
|
|
|
|
|
|
|
|
|
|
|
200 |
|
|
|
|
|
|
|
|
|
|
|
180 |
|
|
|
|
|
|
|
|
|
|
|
160 |
|
|
|
|
|
|
|
|
|
|
|
140 |
|
|
|
|
|
|
|
|
|
|
|
120 |
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
KН |
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5. 3. Растворимость в |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
Вода |
|
|
|
% мас. |
|
|
|
Никотин |
системе вода - никотин |
||
Наконец, известны системы с ограниченной растворимостью без критических точек. Примерами их могут служить вода - хлороформ и вода - эфир. По-видимому, такое поведение систем имеет место при малой взаимной растворимости образующих их жидкостей и объясняется невозможностью достижения критической точки, так как, например, при понижении температуры начинается кристаллизация одного из компонентов, а при повышении критическая точка одного жидкого слоя достигается быстрее критической точки растворения и, таким образом, одна из жидкостей исчезает. Так, в системе вода - эфир при 3.83°С начинается кристаллизация, и один из слоев (водный) исчезает. При температуре 201°С раствор воды в эфире достигает своей критической точки и выше этой температуры не существует в виде жидкой фазы.
Вообще в настоящее время есть точка зрения, согласно которой кривая растворимости для любой пары жидкостей принципиально должна быть замкнутой. Если же мы, тем не менее, не для всех систем можем наблюдать и ту и другую критические точки, то это объясняется недостижимостью их вследствие наступающих процессов кристаллизации, кипения или перехода в критическое состояние.
Скажем еще несколько слов о влиянии третьего компонента на взаимную растворимость двух жидкостей. Строго говоря, этим мы уже переходим к рассмотрению тройных систем, но этот вопрос удобнее изучить здесь. Если ка- кое-либо третий компонент растворим в одной жидкости, но не растворим в другой, то при его прибавлении взаимная растворимость жидкостей падает,
