
С.А. Мазунин, Г.С. Посягин ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА Часть 1. 1999г
..pdf51
нится и может быть определен по точкам отрезка ЕО кривой жидкости, а соответствующий состав пара - по точкам отрезка FN кривой пара. Точки второго отрезка лежат ближе к вертикали, проходящей через В, чем соответствующие точки отрезка ЕО; пар будет относительно богаче тем компонентом, прибавление которого понижает точку кипения. Это правило, аналогичное первому закону Гиббса-Коновалова, имеет место и для систем с экстремальной точкой кипения , в чем можно убедиться при рассмотрении рис.5.16 и 5.17.
Таблица 5.1 Температуры кипения азеотропных смесей при атмосферном давлении
|
Температура кипе- |
Температура ки- |
Содержание 2-го комп. в |
|
Система |
ния, °С |
пения азеотроп- |
азеопной |
|
1-го |
2-го |
ной смеси, °С |
смеси, % моль. |
|
|
комп. |
комп. |
|
|
а) |
Минимальные температуры кипения |
|||
этиловый спирт- |
78.5 |
79.6 |
68.24 |
44.8 |
бензол |
|
|
|
|
хлороформ - этиловый |
61.2 |
78.5 |
59.3 |
84 |
спирт |
76.8 |
78.5 |
64.95 |
61.3 |
четыреххлористый уг- |
||||
лерод - этиловый |
|
|
|
|
спирт |
|
|
|
|
этиловый спирт - вода |
78.5 |
100 |
78.15 |
89.43 |
сероуглерод - ацетон |
46.3 |
56.3 |
39.25 |
61 |
б) Максимальные температуры кипения |
||||
ацетон - хлороформ |
56.3 |
61.2 |
64.5 |
34.5 |
хлороводород - вода |
-85 |
100 |
110 |
88.9 |
бромоводород - вода |
-67 |
100 |
126 |
83.1 |
иодоводород - вода |
-35.7 |
100 |
127 |
84.3 |
фтороводород - вода |
19.4 |
100 |
120 |
65.4 |
серный ангидрид - во- |
44.6 |
100 |
338 |
50.8 |
да |
|
|
|
|
азотная кислота - вода |
86 |
100 |
120.5 |
62.2 (при 745 |
|
|
|
|
мм. рт. ст.) |
Точно так же имеется правило, аналогичное второму закону ГиббсаКоновалова, которое формулируется следующим образом: экстремуму на кривой точек кипения двойной жидкой системы отвечают жидкие и парообразные фазы с одинаковым составом.
При кипении смеси, состав которой точно отвечает экстремуму кривой точек кипения, состав выделяющегося пара такой же, как и кипящей жидкости, благодаря чему в процессе кипения состав последней не изменяется, а также не изменяется и точка кипения. Поэтому азеотропные смеси, кипящие при постоянной температуре, называются иначе постоянно кипящими или нераздельно кипящими смесями.

52
T |
T |
T |
T |
|
V |
||
V |
|
|
|
|
|
|
|
M |
|
|
L+V |
L+V |
L+V |
|
L+V |
|
|
||
L |
|
|
M |
|
|
L |
 A B A B
A B A B
Рис. 5.16. Изобарическая кривая x,t с Рис. 5.17. Изобарическая кривая x,t с максимумом минимумом
Раньше предполагали, что такие смеси представляют собой химическое соединение компонентов, но от этого взгляда пришлось отказаться, когда было доказано, что при изменении внешнего давления изменяется не только точка кипения, но и состав такой смеси.
Обращаем внимание на то, что давление пара азеотропной смеси зависит только от температуры, и температура же точно определяет ее состав; таким образом, мы здесь имеем моновариантное равновесие; между тем наша система, как образованная двумя компонентами и состоящая из двух фаз, должна была бы быть дивариантной. Причина этого кажущегося противоречия заключается в том, что в этом случае составы жидкой и парообразной фаз одинаковы; поэтому здесь имеет силу ограничение правила фаз, указанное Ван-дер-Ваальсом, и система ведет себя как однокомпонентная.
На применении диаграмм кипения основана теория перегонки смесей. Различают три вида такой перегонки: простую, фракционированную и перегонку в равновесии.
При простой, или, как ее называют иначе, дифференциальной, перегонке мы перегоняем смесь, например, состава a (рис.5.18), причем пар отводим в холодильник, где он и сгущается. Если в течение некоторого времени жидкость в перегонном кубе приняла в результате перегонки состав b, то пар, который в начале перегонки имел состав а′, теперь имеет состав b′; весь же сконденсировавшийся в этот промежуток времени пар изображается точкой, лежащей между а' и b' . Таким образом, в этот момент достигнуто некоторое разделение исходной жидкости на две; одна из них относительно богаче компонентом А, а другая компонентом B. Легко видеть, что такая перегонка более или менее эффективна при резкой разнице в температурах кипения компонентов.

53
T T T T
 TA
TA  TA
TA
TB |
TB |
B |
a' b' a b aк |
A |
B |
|
c1 c2 b1b2b3a1a2 a3 a3 A
Рис. 5.18. Диаграмма простой перегонки Рис. 5.19. Диаграмма фракционированной перегонки
При фракционированной, или дробной, перегонке мы собираем и конденсируем выходящий из перегонного куба пар отдельными порциями. Пусть состав исходной жидкости а1 (рис.5.19); при нагревании ее до кипения она начинает выделять пар состава b1; через некоторое время состав жидкости будет а2, а всего выделившегося пара - b2; мы конденсируем этот пар и получаем первую фракцию состава b2; продолжая вести перегонку таким же образом и дальше, получаем следующую фракцию состава b3 и так далее. Теперь подвергнем перегонке первую фракцию состава b2 и получим из нее фракции с1, с2 и т.д. Далее разгоняем на фракции вторую фракцию состава b3 и поступаем аналогичным образом со всеми фракциями. Из рис.5.19 видно, что мы получим целый ряд фракций, обогащенных более летучим компонентом В. На практике при проведении дробной перегонки соединяют вместе полученные фракции с близким составом, а потом подвергают полученные смеси перегонке. В конце концов получают две фракции: одну сильно обогащенную компонентом А, а другую - компонентом В.
При достаточно долгом проведении этой операции можно получить даже практически чистые компоненты. На заводах часто видоизменяют описанный способ перегонки и применяют так называемую ректификацию, при которой дробная перегонка при помощи особых ректификационных колонн ведется непрерывно, причем смешение фракций производится автоматически.
При третьем способе перегонки - перегонке в равновесии - ведут испарение смеси, не отделяя от нее пара, и только в известный момент производят это отделение и конденсацию. Пусть исходная смесь имеет состав а (рис. 5.18); нагреваем ее, причем первый выделяющийся из нее пар имеет состав а′; через некоторое время состав жидкости будет b, а пара b′. В этот момент отделяем и
54
конденсируем пар, причем получаем две жидкости b и b′, обогащенные по сравнению с исходной жидкостью состава а: первая - компонентом А, а вторая - компонентом В.
Только что было показано, что в результате перегонки мы получаем фракции, обогащенные одна одним, а другая - другим компонентом. Подвергая эти фракции перегонке, мы получаем дальнейшее обогащение и, продолжая этот процесс дальше, добиваемся даже разделения компонентов. Однако последнее возможно лишь в том случае, когда в системе нет азеотропных смесей; если же в системе имеются такие смеси, то исходную жидкость можно разделить перегонкой на эту смесь и тот компонент, который присутствует в избытке по сравнению с составом этой смеси.
При расчете перегонных аппаратов имеют значение так называемые кривые, или диаграммы равновесия, которые строятся следующим образом: откладывают по одной оси прямоугольной системы координат состав пара, а по другой - состав жидкости, находящейся в равновесии, причем давление считается постоянным и, таким образом, означенная диаграмма дает зависимость между составом пара и соответствующей жидкости при температурах кипения последней. По нашему мнению, указанные диаграммы лучше называть кривыми или диаграммами распределения.
5.4. Диаграммы кипения расслаивающихся жидкостей
Рассмотрим теперь случаи, когда жидкости не обладают полной смешиваемостью. Надо иметь в виду, что если две жидкие фазы двойной системы находятся в равновесии друг с другом, то парциальные давления каждого из компонентов для этих фаз соответственно равны. В самом деле, если, например, парциальное давление компонента А одной из фаз меньше, чем другой, то он будет испаряться из второй фазы и конденсироваться на первой, и, таким образом, система не будет находиться в равновесии. Соответствующие же равенства парциальных давлений влекут за собой равенство полных давлений, представляющих собой суммы парциальных давлений. Итак, если две жидкие фазы находятся в равновесии, то давления их паров одинаковы, а сами пары тождественны.
Перейдем теперь к построению изотермических диаграмм давления пара двойной жидкой системы, в которой имеет место расслаивание. Здесь возможны два случая:
а) оба компонента при прибавлении их друг к другу повышают соответственно общее давление пара;
б) один из компонентов при прибавлении его к системе повышает общее давление пара, а другой - понижает.
Случай а): компоненты А и В, будучи прибавленными к системе, вызывают соответственно повышение общего давления пара (рис.5.20); кривая общего давления пара в функции состава жидкости состоит из двух ветвей В′С′ и А′D′, отвечающих двум жидким фазам. Фазы состава С и D находятся в равно-

55
весии друг с другом, соответственно чему давления их паров СС′ и DD′ равны; система с валовым составом, изображенным точкой, лежащей между С и D, при данной температуре состоит из двух слоев состава С и D; давление ее пара равно давлению пара этих слоев. Если изобразить ту же кривую как функцию состава пара, то получатся тоже две ветви В′Е и А′Е, пересекающиеся в точке Е, показывающей давление и состав пара слоев, находящихся в равновесии.
На рис. 5.20, 21 мы видим снова подтверждение принципа соответствия: каждой жидкой фазе соответствуют ветви кривой давления пара: В′С′ и А′D′ - на первой диаграмме и В′Е и А′Е - на второй. Диаграмма, отвечающая более высокой температуре, имеет аналогичную форму, но лежит несколько выше; кроме того, точки С′, D′ и Е изменяют свое положение. Если растворимость жидкостей при повышении температуры возрастает, то при более высокой температуре точки С′ и D′ будут лежать ближе друг к другу; если же растворимость при повышении температуры убывает, то эти точки будут лежать дальше друг от друга.
P |
P |
T |
T |
|
C'' |
D'' |
|||
|
TA |
TB |
C' |
D' |
E |
C' |
|
B'
 A'
A'
B C |
D |
A |
BC"C |
|
|
|
E |
D' |
DD"A
Рис. 5.20. Диаграмма x, p для смеси рас- |
Рис. 5.21. Диаграмма x, t для смеси рас- |
слаивающихся жидкостей (случай 1-й) |
слаивающихся жидкостей (случай 1-й) |
Обычно на диаграмму наносят геометрические места точек С и D, отвечающие разным температурам. На рис.5.20 даны такие линии С′С′′ и D′D′′, причем изображенная диаграмма отвечает первому из указанных случаев, когда растворимость возрастает с повышением температуры.
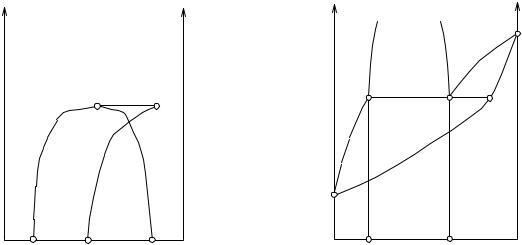
Пользуясь методом, изложенным ранее, перейдем от диаграммы x, p к диаграмме x, t. В данном случае мы получим диаграмму, изображенную на рис.5.21, причем на рис.5.20 и 5.21 соответствующие точки обозначены одинаковыми буквами, но точки А′ и В′, отвечающие температурам кипения чистых компонентов, на рис. 5.21 обозначены соответственно ТА и ТВ. На рис. 5.21 мы имеем следующие элементы: кривая ТВС′ дает точки кипения смесей разных концентраций, богатых компонентом В, а ТАD′ - смесей, богатых компонентом А, причем в качестве независимой переменной принят состав жидкости. Кривые ТВЕ и ТАЕ дают температуры кипения как функцию состава пара. Если на
56
тот же чертеж нанесем диаграмму, отвечающую более низкому давлению, то получим на этом чертеже еще одну диаграмму, аналогичную описанной, но расположенную ниже; точки С и D на этой диаграмме будут находиться на большем расстоянии друг от друга, так как мы рассматриваем случай уменьшения растворимости с понижением температуры; на рис. 5.21 линии С′С′′ и D′D′′ представляют собой геометрические места этих точек.
Часто бывает полезным иметь диаграмму, изображающую составы жидких слоев и отвечающего им пара в зависимости от температуры; для получения такой диаграммы строят геометрические места точек С′, D′ и Е. На рис. 5.22 мы имеем такую диаграмму, отвечающую разобранному нами случаю. Линия СКD - уже известная нам диаграмма растворимости жидкостей, линия же FЕ дает состав пара находящихся в равновесии жидких фаз в зависимости от температуры; точка К - критическая точка растворимости. В данном случае пар, находящийся в равновесии с обоими жидкими слоями, имеет состав, средний между составами жидких слоев.
T T P P C" D" A'
K |
E |
C' |
D' |
E |
|
|
|
|
|
|
|
B' |
|
B C |
F |
D A |
B |
A |
Рис. 5.22. Диаграмма растворимости и кри- |
Рис. 5.23. Диаграмма x, p для смеси рас- |
|||
вая состава пара для смеси расслаивающих- |
слаивающихся жидкостей (случай 2-й) |
|||
ся жидкостей (случай 1-й) |
|
|
||
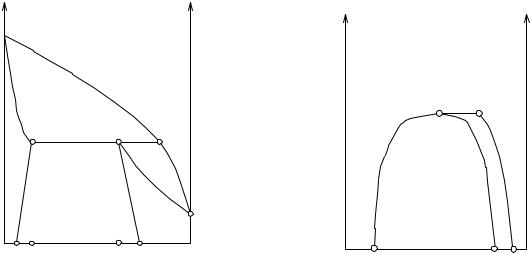
Однако может представиться другой случай: пар, находящийся в равновесии с двумя жидкими фазами, более богат одним из компонентов, чем оба жидких слоя, и точка, отвечающая составу пара (Е на рис.5.20 и 5.21), лежит не между точками, отвечающими составу жидких слоев (С и D на рис 5.20 и 5.21), а вне их. В этом случае диаграмма x,p имеет вид, представленный на рис. 5.23: кривые В′С′ и D′А′ дают общее давление пара как функцию состава жидкости, В′Е и А′Е - как функцию состава пара. Рис. 5.24 дает диаграмму x, t для этого случая.
Обозначения на рис. 5.23 и 5.24 соответствуют обозначениям на рис. 5.20 и 5.21. На рис.5.25 даны кривая растворимости в нашей системе и кривая состава пара слоев, находящихся в равновесии для этого случая; обозначения здесь отвечают обозначениям на рис.5.22. Легко видеть, что это и есть случай
57
б), когда один из компонентов при прибавлении его к системе повышает, а другой - понижает общее давление пара.
T T T T
B'
|
|
K |
E |
C' |
D' |
E |
|
|
|
|
|
A' |
|
|
|
|
|
|
A |
|
|
BC"C |
D D" |
B C |
D F A |
|||
Рис. 5.24. Диаграмма кипения для |
Рис. 5.25. Диаграмма растворимости и кривая со- |
|||||
двух расслаивающихся жидкостей |
става пара для смеси расслаивающихся жидкос- |
|||||
|
|
(случай 2-й) |
|
тей ( случай 2-й) |
||
При кипячении соляных растворов было замечено, что термометр, шарик которого вставлен в пар, показывает обычно температуру, почти равную температуре кипения чистого растворителя, хотя раствор закипает при значительно более высокой температуре. Далее было замечено, что чем менее летуче растворенное вещество, тем ближе температура, показываемая расположенным вышеуказанным способом термометром, к температуре кипения чистого растворителя.
Розебом так объясняет это явление. Рассмотрим часть диаграммы точек кипения растворов малолетучего вещества А в жидкости В (рис. 5.26). Пусть В′А′ - линия жидкости, а В′А′′ - линия пара. Дан раствор состава а, который закипает при температуре аа1 (ВЕ), причем выделяется пар, состав которого изображается точкой а2. Если пар охлаждается на ∆t = а2а′′, то он частично сконденсируется в жидкость, и отношение количества этой жидкости к количеству оставшегося пара определяется отношением (са′′)/(а′′а′). Допустим, что этого количества достаточно для того, чтобы теплом, выделившимся при конденсации, компенсировать тепловые потери и тем воспрепятствовать дальнейшему падению температуры пара. Тогда термометр, шарик которого введен в пар, покажет температуру ВЕ1.
Возьмем теперь раствор еще менее летучего вещества. Содержание его в паре будет меньше, чем в описанном случае, и поэтому кривая пара пойдет круче; пусть она будет В′А′′′. Тогда при охлаждении пара состава а3 на ту же величину ∆t из него сконденсируется некоторое количество жидкости; отношение этого количества к количеству оставшегося пара определится отношением (dа′′′)/(а′′′а′) и будет, как видно из сравнения этих отношений, значительно меньше, чем в первом случае; его может оказаться уже недостаточно для вос-

58
препятствования дальнейшему охлаждению пара, и температура последнего упадет еще ниже; при этом количество сконденсировавшейся жидкости будет возрастать до тех пор, пока количество тепла, выделяющегося при этой конденсации, не будет достаточным для компенсации тепловых потерь пара.
Таким образом, мы видим, что чем менее летуче растворимое вещество, тем ниже при прочих равных условиях будет температура пара, выделяющегося при кипячении раствора этого вещества. В предельном случае, когда растворенное вещество совершенно нелетуче, кривая совпадает с осью температур и температура отходящего пара будет равна температуре кипения чистого растворителя. Поэтому при определении температуры кипения раствора шарик термометра следует вводить в жидкость, а не в пар.
T
A'''
A"
E |
a3 |
a2 |
a1 A' |
|
d |
|
|
|
|
E1 |
|
|
|
|
a''' c |
a" |
a' |
|
|
B' |
|
|
|
Рис. 5.26. Диаграмма для |
|
|
|
|
объяснения разности тем- |
|
|
|
a |
ператур кипящего раство- |
B |
|
|
A |
ра и его пара |
6. Системы, образованные газообразной и твердой фазами
Рассмотрим систему, один из компонентов которой газ, а другой твердое вещество. Примем сначала, что в нашей системе не образуются твердые растворы и газ не адсорбируется твердыми фазами. Пусть газ А образует с твердым веществом В соединение АВ по уравнению
А(г) + В(т) == АВ(т). (6.1)
Если при постоянной температуре в равновесии находятся три фазы: газообразная А, твердая В и твердая АВ, то равновесие двухкомпонентной системы будет условно нонвариантно. Следовательно, для этой температуры мы будем иметь вполне определенное давление газа, при котором возможно данное равновесие. Если мы попытаемся несколько увеличить давление газа, то это удастся лишь после того, как В целиком перейдет в АВ. С другой стороны, при попытке уменьшить давление газа А целиком разложится АВ.
Посмотрим теперь, что произойдет, если к твердой фазе В, помещенной в вакуум, впускать небольшими порциями газ А, для чего построим диаграмму, приведенную на рис. 6.1. На оси ординат отложим давление газа р, на оси абс-

59
цисс - валовой состав конденсированной части данной системы, т.е. ее твердых фаз, который будем выражать числом молей А, приходящихся на один моль В.
При наличии в системе одного чистого вещества В, помещенного в вакууме, состояние системы изобразится началом координат - точкой В. Затем при впускании небольших порций газа А давление его будет расти, а фигуративная точка системы подниматься, не сходя с оси давлений. Только после достижения давлением величины, соответствующей равновесию газа А с твердыми фазами В и АВ (точка С), начнется образование соединения АВ, причем давление будет оставаться постоянным. Фигуративная точка при этом будет двигаться по горизонтальной прямой СD, так как теперь при постоянном давлении изменяется суммарный состав конденсированной части нашей системы (фазы В и АВ).
P |
|
|
|
|
P |
A |
|
|
E |
|
F |
|
|
B |
|
700 |
|
|
|
|
|||
|
|
|
|
|
|
||
600 |
|
|
|
|
|
G |
|
|
|
|
|
|
|
|
|
500 |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
400 |
|
|
|
|
|
|
|
300 |
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
200 |
D |
|
|
|
O |
E |
T |
C |
|
|
|
D |
|||
|
|
|
|
|
|
||
100 |
|
|
|
|
OA: CuSO4·5H2O+V |
|
|
0 |
|
|
|
|
|
||
G |
|
|
|
OB: CuSO4·3H2O+V |
|
||
0 |
1 |
2 |
3 |
M A |
OC: CuSO4·H2O+V |
|
|
B |
B·A |
|
B·3A |
|
|
|
|
Рис. 6.1. Изотерма давления пара двойной |
Рис. 6.2. Кривые давления пара гидратов |
системы А-В с образованием химического |
сульфата меди |
соединения при отсутствии адсорбции |
|
Только после того, как В целиком перейдет в АВ, т.е. когда конденсированная часть нашей системы будет состоять из одного АВ (точка D), начнется дальнейшее повышение давления, и фигуративная точка опять начнет подниматься по вертикальной линии. Если в нашей системе образуется еще одно соединение, более богатое компонентом А, то по достижении соответствующего давления начнется его образование, причем фигуративная точка системы опять будет двигаться по горизонтальной линии EF.
Таким образом, изотерма давления пара нашей системы будет ступенчатой линией BCDE. Химическим соединениям будут отвечать разрывы непрерывности ВС, DE и т.д. Классическим примером такой системы может служить система, образованная сульфатом меди с водяным паром. Как известно, в этой
системе возможно образование кристаллогидратов по уравнениям |
|
СuSО4 + Н2О = СuSО4·Н2О, |
(6.2) |
СuSО4·Н2О + 2Н2О = СuSО4·3Н2О, |
(6.3) |
60 |
|
СuSО4·3Н2О + 2Н2О = СuSО4·5Н2О. |
(6.4) |
На рис. 6.2 показаны кривые давления пара как функции температуры для этой системы. Как мы показали выше, при постоянной температуре равновесие двухкомпонентных систем из двух твердых и газообразной фазы условно нонвариантно. При переменной температуре - они моновариантные. На рис. 6.2 кривые этих моновариантных равновесий будут: ОА для равновесия пар - СuSО4·5Н2О - СuSО4·3Н2О уравнение (6.4); ОВ для равновесия пар - СuSО4·3Н2О - СuSО4·Н2О уравнение (6.3); ОС для равновесия пар - СuSО4·Н2О - СuSО4 уравнение (6.2).
Между этими кривыми располагаются поля дивариантных равновесий системы. Поле между кривой ОС и осью температур отвечает равновесию пар - СuSО4; между кривыми ОС и ОВ равновесию пар - СuSО4·Н2О; между кривыми ОВ и ОА равновесию пар - СuSО4·3Н2О; выше кривой ОА равновесию пар - СuSО4·5Н2О. Это последнее поле сверху будет ограничено кривой моновариантных равновесий пар - насыщенный раствор - СuSО4·5Н2О; выше этой кривой располагается поле дивариантных равновесий пара и ненасыщенных растворов; это поле, в свою очередь, будет сверху ограничено кривой давления пара воды.
Найдем на оси температур точку D, отвечающую температуре 50°С, и проведем через нее вертикальную линию. Она пересечет кривые моновариантных равновесий в точках E, F и G, имеющие соответственно следующие ор-
динаты (мм. рт. ст.): 4.5; 30.9; 45.4.
На рис. 6.3 изображена изотермическая диаграмма этой системы при 50°С, причем давление пара рассматривается как функция состава конденсированной части системы. На изотерме имеется ряд разрывов в точках О, С, Е и G, отвечающих четырем индивидуальным веществам: СuSО4; СuSО4·Н2О;
СuSО4·3Н2О; СuSО4·5Н2О.
При помощи рис. 6.2 можно указать условия выветривания кристаллогидратов. Если парциальное давление паров воды в воздухе меньше, чем давление пара, отвечающего равновесию его с данным гидратом соли и ближайшим нужным гидратом, то будет происходить выветривание, а если больше, то - оводнение вплоть до расплывания соли. Последнее будет иметь место тогда, когда давление водяного пара в воздухе не меньше давления пара насыщенного раствора.
В качестве второго примера равновесия газа с твердыми фазами приведем систему, образованную аммиаком и хлоридом серебра. В этой системе
возможны следующие реакции: |
|
AgCl + NH3 = AgCl·NH3, |
(6.5) |
2(AgCl·NH3) + NH3 = 2AgCl·3NH3, |
(6.6) |
2AgCl·3NH3 + 3NH3 = 2(AgCl·3NH3). |
(6.7) |
На рис. 6.4 дана изотермическая диаграмма давлений аммиака как функция состава конденсированной части системы при 16°С. Мы не будем подробно обсуждать эту диаграмму. Заметим только, что давление аммиака, отвечающее равновесию фаз NH3 - AgCl·NH3 -2AgCl·3NH3, при 20°С равно атмосферному;
