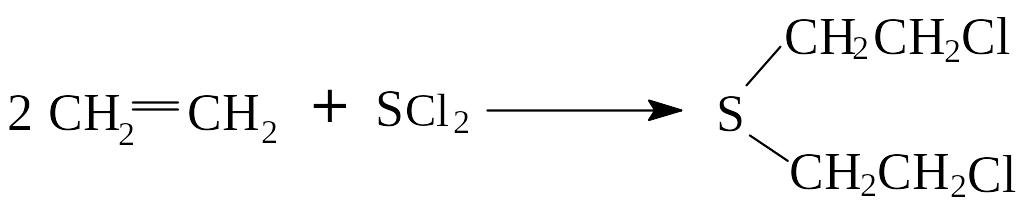- •Молекула этилена
- •1.2. Гомологический ряд алкенов
- •1.3. Номенклатура алкенов
- •1.4. Изомерия алкенов
- •2. Способы получения алкенов
- •1) Крекинг нефти
- •2) Дегидрогалогенирование алкилгалогенидов
- •3) Дегидратация спиртов
- •4) Дегалогенирование вицинальных дигалогенидов
- •5) Восстановление алкинов
- •3. Свойства алкенов
- •3.1. Физические свойства
- •3.2. Общая характеристика химических свойств
- •3.3. Основные химические реакции
- •1) Реакции присоединения
- •2) Реакции окисления
- •3) Реакции замещения
- •4) Реакции полимеризации
- •4. Основные представители алкенов
- •5. Экологические аспекты химии алкенов
- •Этилен в живой природе
- •Биоразлагаемые полимеры
- •6. Вопросы и задачи по теме «алкены»
- •Литература
3.3. Основные химические реакции
1) Реакции присоединения
Присоединение водорода. Каталитическое гидрирование
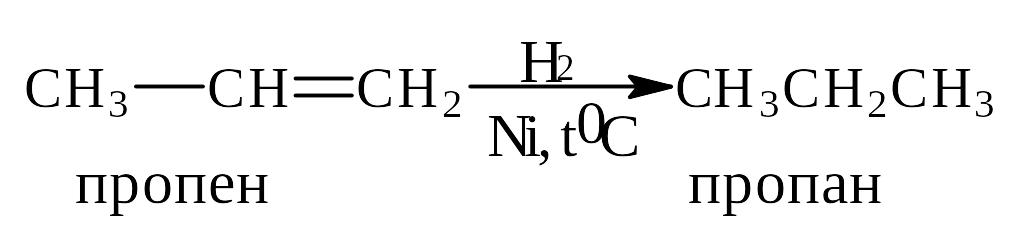
Гидрирование алкенов является одним из наиболее удобных методов синтеза алканов. Кроме того, эта реакция - общий способ превращения двойной углерод-углеродной связи в простую углерод-углеродную связь.
Гидрирование - экзотермическая реакция. Количество тепла, выделяемого при гидрировании 1 моля почти всех алкенов, равно ~125 кДж/моль. Однако в отсутствие катализатора она протекает с незначительной скоростью даже при повышенной температуре. Роль катализатора заключается в понижении энергии активации настолько, чтобы реакция может достаточно быстро протекать при комнатной температуре. Другими словами роль катализатора заключается в снижении энергетического барьера между исходными соединениями и конечными продуктами реакции.
Присоединение галогенов
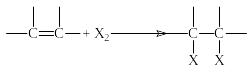 - где Х2=Cl2;
Br2
- где Х2=Cl2;
Br2
Например,
![]()
Присоединение брома обычно используют для обнаружения двойной углерод-углеродной связи. Раствор брома в четыреххлористом углероде окрашен в красный цвет, а дигалогениды, так же как алкены, бесцветны. Быстрое обесцвечивание раствора брома указывает на присутствие соединений, содержащих двойную углерод-углеродную связь.
Присоединение галогенов к алкенам является стереоспецифичной реакцией: присоединение происходит по транс-направлению.
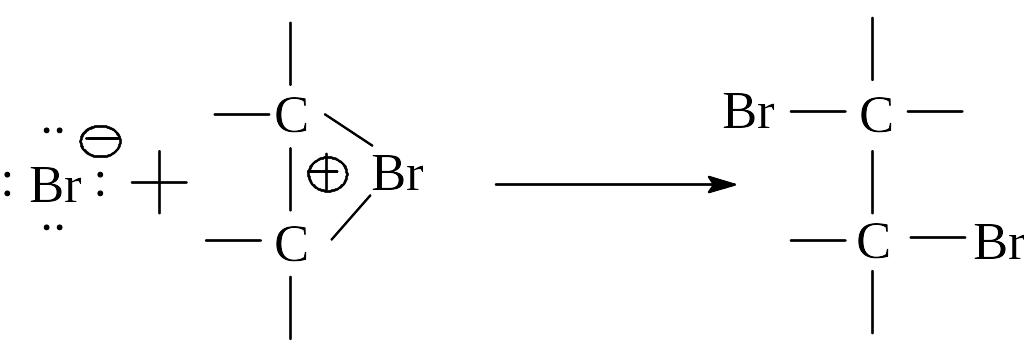
Для объяснения стереоспецифичности присоединения брома к алкенам было выдвинуто предположение об образовании циклического промежуточного соединения, в котором бром связан с обоими атомами углерода двойной связи. Такой “мостиковый” ион получил название бромониевого иона, поскольку бром в нем формально несет положительный заряд.
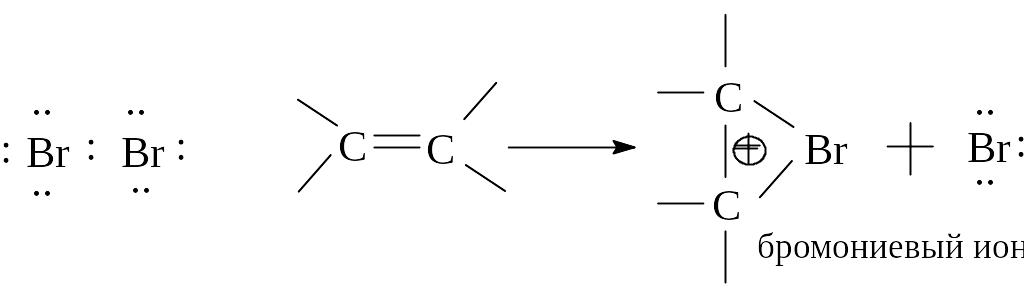
Реакцию завершает атака бромид-аниона на атом углерода со стороны, противоположной той, где расположена мостиковая группа, с образованием продукта транс-присоединения.
Присоединение галогеноводородов
Алкены реагируют с хлористым, бромистым или иодистым водородом с образованием соответствующих алкилгалогенидов. Реакцию обычно проводят, пропуская газообразный галогенводород непосредственно через алкен. Иногда используют растворитель средней полярности, например, уксусную кислоту, которая растворяет и полярный галогенводород, и неполярный алкен. Русским химиком В.В. Марковниковым исследовано большое количество реакций несимметрично построенных алкенов с галогенводородами и установлена возможность образования двух изомерных продуктов, при преобладании одного из них:
 СН3-СН=СН2
+HJ CH3-CHJ-CH3
+ CH3-CH2-CH2J
СН3-СН=СН2
+HJ CH3-CHJ-CH3
+ CH3-CH2-CH2J
2-иодпропан 1-иодпропан
В 1869 г. Марковников сформулировал правило, согласно которому: “При ионном присоединении кислоты к двойной углерод-углеродной связи несимметричного алкена водород кислоты присоединяется к атому углерода, который несет наибольшее число атомов водорода (к наиболее гидрогенизированному атому углерода), а галоген к соседнему”.
Правило Марковникова не универсально, тем не менее им можно с успехом пользоваться, если ограничить сферу его применения полярными реакциями присоединения к углеводородам, содержащим только одну двойную связь. Сам Марковников рассматривал его как одно из частных проявлений общего закона, определяющего взаимное влияние атомов в молекулах органических соединений.
В свете современных электронных представлений правило Марковникова нашло простое и естественное объяснение. Углеводородные радикалы при углеродных атомах, связанных кратной связью, обладают способностью нагнетать электроны (отталкивать от себя связующую электронную пару) и проявлять тем самым положительный индуктивный эффект. В результате чего электроны кратной связи смещаются к наиболее гидрогенизированному атому углерода, и он приобретает частичный или дробный отрицательный заряд и становится способным притягивать протон галогенводородов:
 δ-
δ-
 СН3→СН=СН2
+ Н-Br
CH3-CHBr
-CH3
СН3→СН=СН2
+ Н-Br
CH3-CHBr
-CH3
Если при кратной связи стоят электроноакцепторные заместители, двойная связь поляризуется таким образом, что дробный отрицательный заряд появляется у наименее гидрогенизированого атома углерода, и протон галогеноводорода атакует именно этот атом углерода, что противоречит правилу Марковникова в его формальном понимании, но происходит в соответствии с его электронной сущностью:
 δ-
δ-
СF3← CH=CH2 +H-Br → CF3-CH2-CH2Br
Таким образом, правило Марковникова, с точки зрения электронных представлений, можно сформулировать так: присоединение реагента Н-Х к несимметричной двойной связи субстрата происходит таким образом, что катион реагента связывается с отрицательно заряженным атомом углерода, а анион реагента - с положительно заряженным атомом углерода субстрата, с образованием более устойчивого промежуточного карбкатиона.
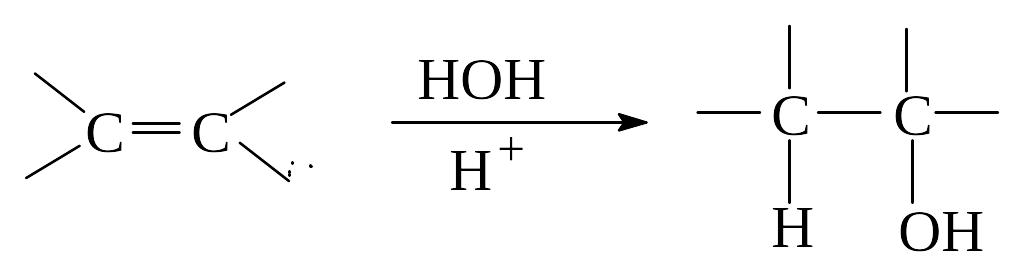
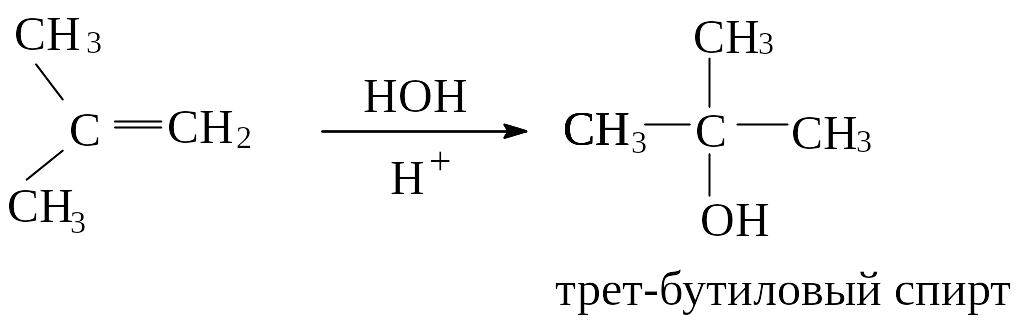
Присоединение воды (гидратация)
Например:
Н+
 СН3-СН=СН2
+ Н2О
СН3-СН(ОН)-СН3
СН3-СН=СН2
+ Н2О
СН3-СН(ОН)-СН3
пропанол-2
Вода присоединяется к алкенам в присутствии кислот с образованием спиртов в соответствии с правилом Марковникова. Гидратация алкенов широко используется в промышленности для синтеза низших спиртов.
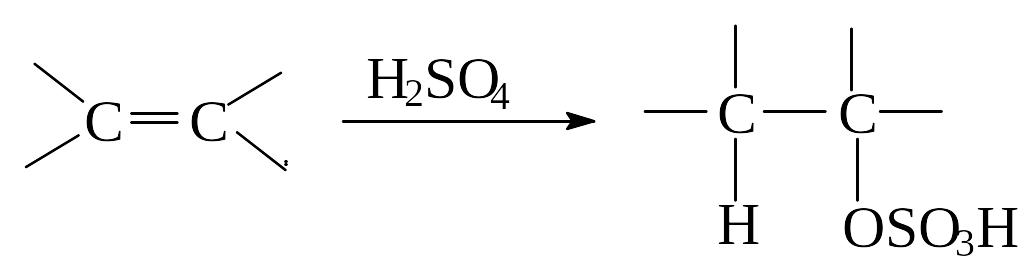
Присоединение серной кислоты
Например:
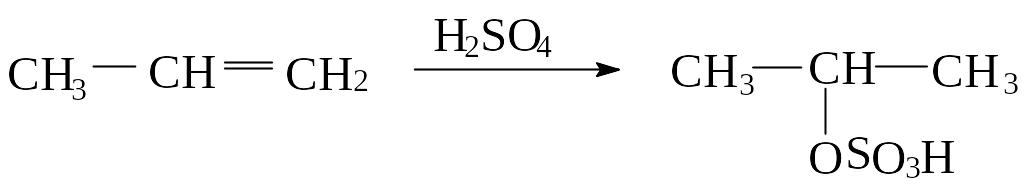
изопропилсульфат
Алкены реагируют с концентрированной серной кислотой на холоду с образованием кислых алкилсульфатов общей формулы ROSO3H. Присоединение серной кислоты происходит по правилу Марковникова. Важно отметить, что углерод образует связь с кислородом, а не с серой. Реакция осуществляется легко: газообразный алкен пропускают через кислоту, жидкий алкен перемешивают или встряхивают с кислотой. Кислые алкилсульфаты – твердые гигроскопические вещества, которые трудно выделить. Они легко разлагаются водой с образованием спирта и серной кислоты:
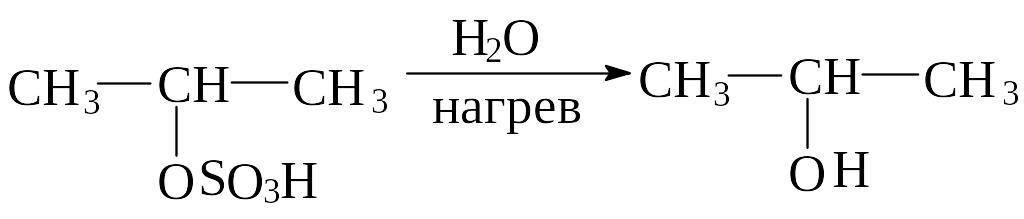
Присоединение хлористой серы
Этилен взаимодействует с хлористой серой с образованием отравляющего вещества кожно-нарывного действия - иприта.
-дихлордиэтилсульфид