
- •Молекула этилена
- •1.2. Гомологический ряд алкенов
- •1.3. Номенклатура алкенов
- •1.4. Изомерия алкенов
- •2. Способы получения алкенов
- •1) Крекинг нефти
- •2) Дегидрогалогенирование алкилгалогенидов
- •3) Дегидратация спиртов
- •4) Дегалогенирование вицинальных дигалогенидов
- •5) Восстановление алкинов
- •3. Свойства алкенов
- •3.1. Физические свойства
- •3.2. Общая характеристика химических свойств
- •3.3. Основные химические реакции
- •1) Реакции присоединения
- •2) Реакции окисления
- •3) Реакции замещения
- •4) Реакции полимеризации
- •4. Основные представители алкенов
- •5. Экологические аспекты химии алкенов
- •Этилен в живой природе
- •Биоразлагаемые полимеры
- •6. Вопросы и задачи по теме «алкены»
- •Литература
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Саратовский государственный технический университет
АЛКЕНЫ
Методические указания
для подготовки к занятиям по дисциплине «Органическая химия»
для студентов специальности 02080165 «Экология»
Одобрено
редакционно-издательским советом
Саратовского государственного
технического университета
Саратов 2007
1. СТРОЕНИЕ, НОМЕНКЛАТУРА, ИЗОМЕРИЯ АЛКЕНОВ
Алкены – ненасыщенные углеводороды с открытой цепью, содержащие в молекуле одну двойную связь. Простейшим представителем алкенов является этилен С2 Н4, в связи с чем соединения этого ряда называют этиленовыми углеводородами. Для них применяется также название олефины, которое происходит от латинского названия gas olefiant – маслородный газ. Это название было дано этилену в XVII веке голландскими химиками из-за его способности образовывать с хлором жидкое маслянистое вещество – дихлорэтан С2 Н4Сl2.
Атомы углерода, образующие в алкенах двойную связь, находятся в sp2-гибридизации. Двойная связь состоит из одной σ –связи и одной π – связи.
1.1. sp2 – Гибридное состояние атома углерода и π – связь
sp2–Гибридное состояние четырехвалентного атома углерода в алкенах возникает при взаимодействии одной 2s–орбитали и двух 2p–орбиталей. В результате образуются три гибридные sp2–орбитали, расположенные в плоскости под углом в 120; и остается негибридизованной одна р–орбиталь, которая располагается перпендикулярно к остальным:
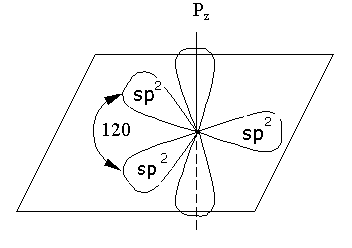
sp2–Гибридные орбитали образуют при перекрывании с электронными орбиталями соседних атомов σ-связи. При боковом перекрывании р–орбиталей двух соседних атомов углерода образуется дополнительная связь, получившая название - связи:
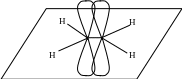
Молекула этилена
Электронная плотность - связи сосредоточена над и под плоскостью, в которой расположены атомы молекулы.
Свойства - связи:
1) -связь является значительно менее прочной связью, чем σ – связь; энергия С=С – связи в этилене равна 607 кДж/моль; длина связи 0,134 нм;
2) направленность – перпендикулярная плоскости σ- связей, - связь пространственно более доступна, чем σ - связь, так как максимум электронной плотности находится над и под плоскостью молекулы;
3) -связь менее стабильна, чем σ - связь; она значительно легче поляризуется под воздействием внешних факторов или заместителей, смещение электронной плотности по -связи называется мезомерным эффектом;
4) двойная связь более жесткая, вращение вокруг π-связи затруднено, это является причиной образования у алкенов геометрических изомеров.
1.2. Гомологический ряд алкенов
Подобно тому, как от метана производится гомологический ряд алканов, так и от этилена производится гомологический ряд этиленовых углеводородов или алкенов. Каждый последующий член этого ряда отличается от предыдущего на гомологическую разность (СН2). Этиленовые углеводороды имеют общую формулу СnН2n:
СН2=СН2 этилен (С2Н4)
СН3-СН=СН2 пропилен (С3Н6)
СН3-СН2-СН=СН2 бутилен-1 (С4Н8)
1.3. Номенклатура алкенов
Тривиальные названия алкенов образуются из названия радикалов соответствующих алканов с добавлением окончания ЕН.
СН3-СН2 – этил |
СН2=СН2 – этилен |
|
|
СН3-СН2-СН2 – пропил |
СН3-СН=СН2 – пропилен |
|
|
СН3-СН2-СН2-СН2 – бутил |
СН3-СН2-СН=СН2 – бутилен |
|
|
|
|
2. По рациональной номенклатуре этиленовые углеводороды представляют как производные этилена, у которого атомы водорода замещены на радикалы. Чтобы указать положение радикалов, углеродные атомы этилена обозначают буквами и или используют приставки сим. (симметрично) и несим. (несимметрично).
СН3-СН=СН2 |
метилэтилен |
|
|
СН3-СН=СН-СН3 |
сим.-диметилэтилен; ,-диметилэтилен |
|
|
|
несим.-диметилэтилен; , -диметилэтилен |
|
|
СН3-СН2-СН=СН2 |
этилэтилен |
3. По систематической номенклатуре названия этиленовых углеводородов составляют из названий соответствующих предельных углеводородов путем замены окончания АН на ЕН, цифрой в конце названия или перед названием углеводорода указывают положение двойной связи (атома углерода, за которым следует двойная связь).За главную цепь принимается самая длинная цепь с двойной связью. Нумерация углеродных атомов начинают с того конца, к которому ближе двойная связь.
СН2=СН2 – этен |
|
СН3-СН=СН2 – пропен |
|
СН3-СН2-СН=СН2 - бутен-1 |
|
СН3-СН=СН-СН3 - бутен-2 |
- изобутен, 2-метилпропен |
Одновалентные радикалы алкенов имеют тривиальные названия. По систематической номенклатуре их названия складываются из названий соответствующих алкенов и окончания ИЛ. Цифрой указывается положение двойной связи. Часто используются тривиальные названия.
Радикал |
Тривиальная номенклатура |
Систематическая номенклатура |
СН2=СН- |
Винил |
этенил |
СН2=СН-СН2- |
Аллил |
2-пропенил |
СН3-СН=СН- |
Пропенил |
1-пропенил |
СН3-СН2-СН=СН- |
Бутенил |
1-бутенил |
СН3-СН=СН-СН2- |
Кротил |
2-бутенил |
С
|
Изопропенил |
1-метилэтинил |

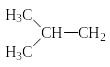 -изобутил
-изобутил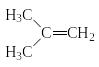 -
изобутилен
-
изобутилен Н2=С-СН3
Н2=С-СН3