
- •2. Алкадиены-1,2 (аллены)
- •2.1. Способы получения
- •2.2. Особенности пространственного строения
- •2.3. Химические свойства
- •3. Алкадиены-1,3 (сопряженные диены)
- •3.1. Способы получения
- •3.2. Физические свойства и особенности строения
- •3.3. Химические свойства
- •1) Реакция гидрирования
- •2) Реакции электрофильного присоединения
- •3) Реакции диенового синтеза
- •4) Реакции полимеризации
- •4. Экологические аспекты химии алкадиенов
- •5. Вопросы и задачи по теме «алкадиены»
- •Литература
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Саратовский государственный технический университет
АЛКАДИЕНЫ
Методические указания
для подготовки к занятиям по дисциплине «Органическая химия»
для студентов специальности 02080165 «Экология»
Одобрено
редакционно-издательским советом
Саратовского государственного
технического университета
Саратов 2007
КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА И ИЗОМЕРИЯ
АЛКАДИЕНОВ
Диеновые углеводороды (алкадиены) – непредельные углеводороды, имеющие две двойные связи (ди – 2, ен – двойная связь).
Общая формула диенов СnH2n–2, т.е они изомерны алкинам. Поскольку для образования двух двойных связей необходимы минимально три атома углерода, то гомологический ряд диенов начинается с соединения СН2=С=СН2 пропадиен – 1,2 (аллен).
Согласно систематической номенклатуре, диеновые углеводороды называют, заменяя окончание «-ан» в предельных углеводородах на «-диен». Положение двойных связей указывают цифрами. Если в молекуле три двойные связи, в конце названия пишут «триен».
Алкадиены классифицируют по взаимному расположению двойных связей в молекуле. Различают алкадиены с сопряженными, кумулированными и изолированными двойными связями.
Алкадиены, в молекулах которых две двойные связи находятся у одного углеродного атома, называются углеводородами с кумулированными двойными связями (аллен и его гомологи).
СН2=С=СН2 пропадиен-1,2 (аллен)
СН3 –СН =С=СН2 бутадиен-1,2 (метилаллен)
Алкадиены, в молекулах которых две двойные связи разделены одной простой связью, называются соединениями с сопряженными двойными связями (дивинил и его гомологи).
СН2=СН –СН =СН2 бутадиен-1,3 (дивинил)
С Н2=С
–СН =СН2 2-метилбутадиен-1,3 (изопрен)
Н2=С
–СН =СН2 2-метилбутадиен-1,3 (изопрен)
СН3
Углеводороды, в молекулах которых две двойные связи разделены двумя и более простыми связями, называются алкадиенами с изолированными двойными связями.
СН2=СН–СН2–СН=СН2 пентадиен-1,4
СН2=СН–СН2–СН2–СН=СН гексадиен-1,5 (диаллил)
Свойства алкадиенов существенно зависят от взаимного расположения двойных связей в молекуле алкадиена. Свойства соединений с изолированными двойными связями в целом сходны со свойствами простых алкенов. Реакции по изолированным двойным связям проходят так же, с теми же реагентами, что и в алкенах. Направление присоединения определяется так же, как в олефинах, правилом Марковникова.
Алкадиены с кумулированными и сопряженными связями имеют свои особенности.
2. Алкадиены-1,2 (аллены)
Аллены представляют собой бесцветные газы (С3, С4) или бесцветные жидкости со слабым запахом. Они труднодоступны.
2.1. Способы получения
1. Аллены можно получить из дигалогеналкенов отщеплением атомов галогена при помощи цинка:
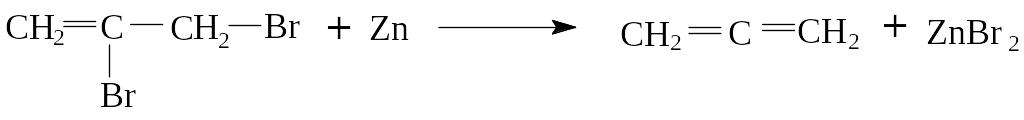
2,3-дибромпропен
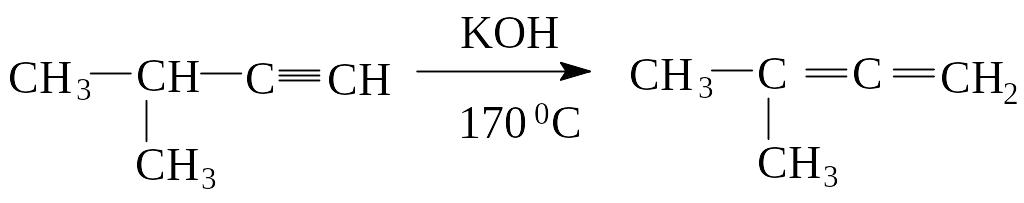
2. Иногда аллены получают перегруппировкой алкинов в присутствии щелочи:
2.2. Особенности пространственного строения
Углеродные атомы в молекуле аллена находятся в различных состояниях гибридизации: центральный атом - в sр-гибридизации, как в ацетилене, а два крайних атома - в sр2-гибридизации, как в этилене. -Связи образуются путем перекрывания р-орбиталей центрального атома и р-орбиталей концевых атомов углерода. Следовательно, все три углеродных атома аллена лежат на одной прямой, а четыре атома водорода во взаимно перпендикулярных плоскостях.
H
H


C
C
C




H
H
Пространственное строение аллена
Для дизамещенных алленов возможна пространственная изомерия:
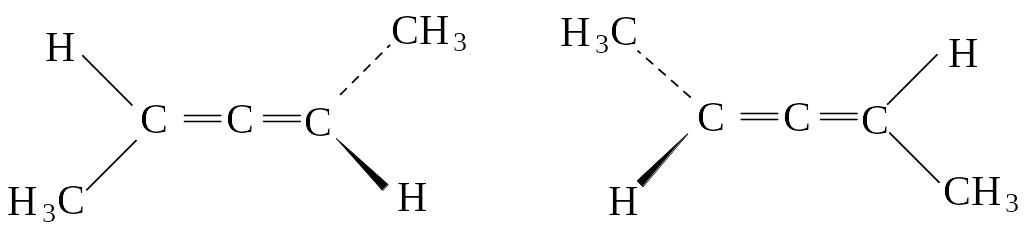
Изомеры являются оптическими антиподами, т.е. энантиомерами.
2.3. Химические свойства
1) Аллены активны в реакциях присоединения. Аллен и его гомологи вступают во многие реакции, характерные для алкенов: они легко гидрируются, присоединяют Br2, HBr, H2O; центром электрофильной атаки являются боковые атомы углерода, т.е. реакции присоединения идут в соответствии с правилом Марковникова.
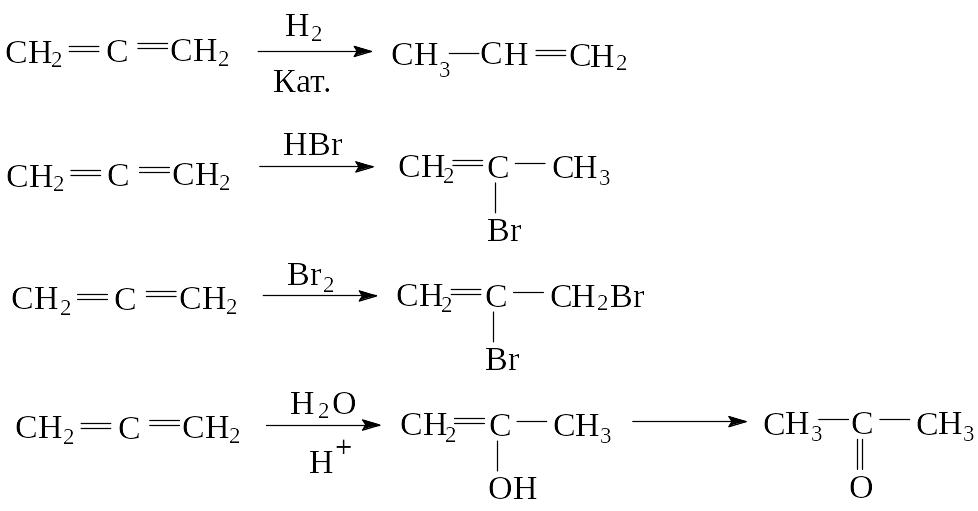
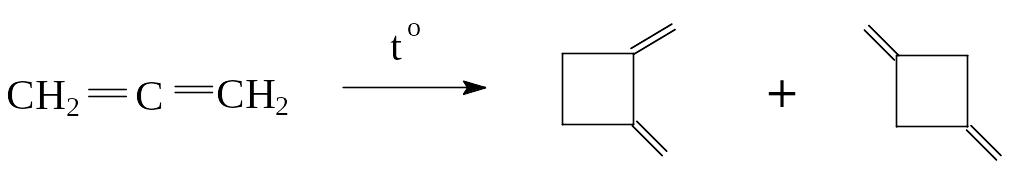
2) Аллены легко полимеризуются как между собой, так и с другими непредельными соединениями, образуя четырехчленные циклы, например:
3) При нагревании и в присутствии сильных оснований (амида натрия в жидком аммиаке) аллены перегруппировываются в алкины.
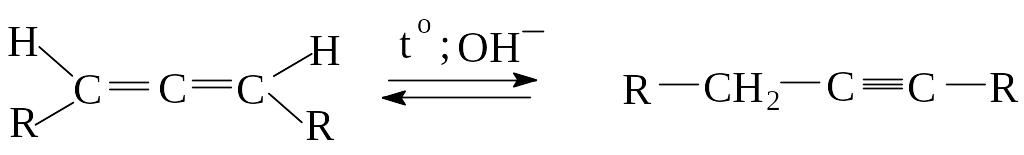
3. Алкадиены-1,3 (сопряженные диены)
3.1. Способы получения
Алкадиены-1,3 получают различными реакциями отщепления из алканов, алкенов, спиртов и галогензамещенных углеводородов. Наибольший интерес представляют способы получения бутадиена-1,3 и изопрена. Мировое производство этих соединений превышает несколько миллионов тонн в год, так как они используются в производстве синтетического каучука.
1) Первым промышленным способом получения бутадиена-1,3 (С.В. Лебедев, 1927) была реакция дегидратации этанола на оксидном катализаторе (Al2O3 + ZnO) при температуре 430-450оС:
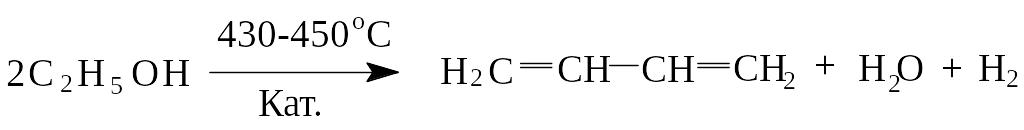
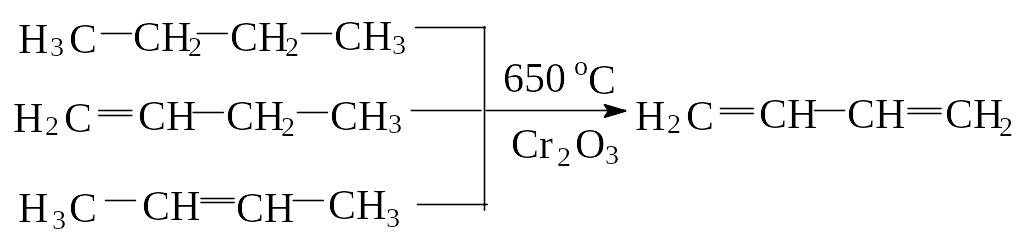
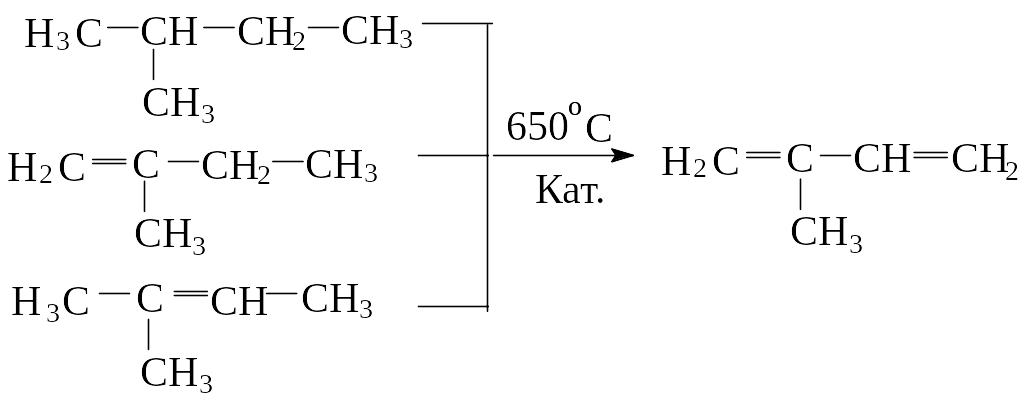
2) В настоящее бутадиен-1,3 и изопрен получают в промышленности дегидрированием бутан-бутиленовых и изопентан-изопентеновых фракций, над оксидными катализаторами:
3) По методу В. Реппе бутадиен-1,3 получают дегидратацией двухатомных спиртов в присутствии гетерогенных катализаторов:
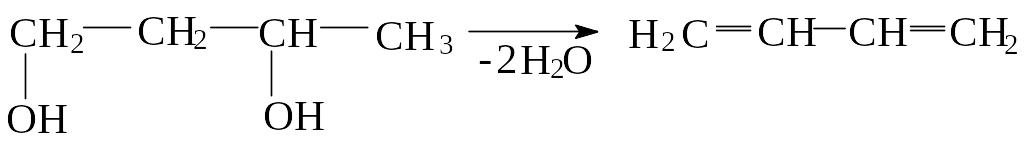
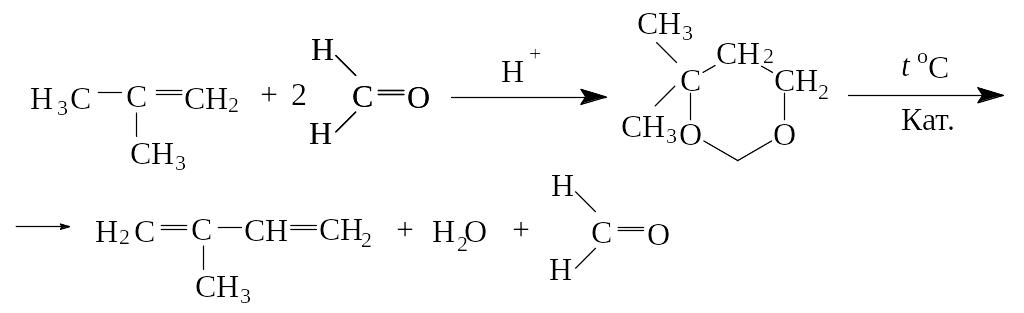
4) В основе еще одного промышленного способа получения изопрена лежит реакция расщепления 4,4-диметил-1,3-диоксана, который получают из изобутилена и формальдегида:
3.2. Физические свойства и особенности строения
Алкадиены-1,3 – это бесцветные вещества. Первые члены гомологического ряда являются газами или низкокипящими жидкостями. Бутадиен-1,3 при обычных условиях – газ, изопрен – жидкость.
Для алкадиенов с сопряженными двойными связями характерны аномально высокие показатели преломления света. По своим химическим свойствам данные соединения существенно отличаются от диенов с кумулированными и изолированными связями. Эти особенности объясняются наличием в молекуле системы сопряженных -связей.
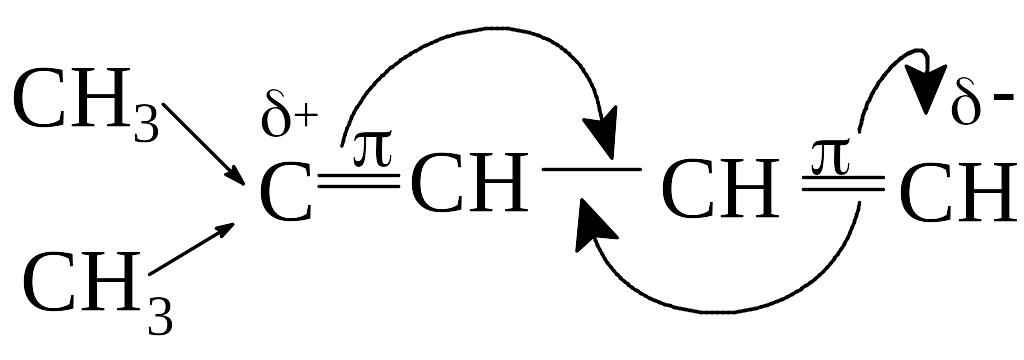
- -сопряжение кратных связей
Сущность эффекта сопряжения в молекулах 1,3-алкадиенов состоит в том, что р-электронные облака атомов углерода в sp2-гибридизации, перекрываясь, образуют единое электронное облако:



С = С - С = С С – С – С – С

Это приводит к изменению длины связей между атомами углерода. Так, в молекуле бутадиена-1,3 длина связи между вторым и третьим атомами углерода равна 0,147 нм вместо 0,154 нм для σ-связи; длина связи между первым и вторым, третьим и четвертым атомами углерода равна 0,136 нм вместо 0,134 нм для π-связи.
