
- •Молекула этилена
- •1.2. Гомологический ряд алкенов
- •1.3. Номенклатура алкенов
- •1.4. Изомерия алкенов
- •2. Способы получения алкенов
- •1) Крекинг нефти
- •2) Дегидрогалогенирование алкилгалогенидов
- •3) Дегидратация спиртов
- •4) Дегалогенирование вицинальных дигалогенидов
- •5) Восстановление алкинов
- •3. Свойства алкенов
- •3.1. Физические свойства
- •3.2. Общая характеристика химических свойств
- •3.3. Основные химические реакции
- •1) Реакции присоединения
- •2) Реакции окисления
- •3) Реакции замещения
- •4) Реакции полимеризации
- •4. Основные представители алкенов
- •5. Экологические аспекты химии алкенов
- •Этилен в живой природе
- •Биоразлагаемые полимеры
- •6. Вопросы и задачи по теме «алкены»
- •Литература
5) Восстановление алкинов
При восстановлении тройной углерод-углеродной связи до двойной возможно образование (если только тройная связь не находится на конце цепи) двух изомерных алкенов: цис- и транс-. Какой из изомеров будет преобладать, зависит от выбора восстанавливающего реагента. Цис-алкен образуется почти исключительно (до 90%) при гидрировании алкинов в присутствии некоторых катализаторов: платины, палладия или бромида никеля. Транс-алкен образуется предпочтительно при восстановлении алкинов натрием или никелем в жидком аммиаке.
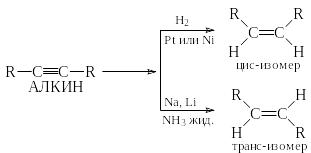
Реакции, приводящие преимущественно к образованию одного из нескольких возможных стереоизомеров, называются стереоселективными. Стереоселективность цис-восстановления алкинов обусловлена присоединением двух водородов с одной и той же стороны алкина, находящегося на поверхности катализатора.
3. Свойства алкенов
3.1. Физические свойства
Агрегатное состояние алкенов с числом атомов углерода в молекуле от 2 до 4 – газы; от 5 до 17 – жидкости; от 18 и больше – твердые тела.
Температуры кипения алкенов подчиняются тем же закономерностям, что и соответствующие алканы. В гомологическом ряду, начиная с С5, Ткип. возрастает на 20-300С с прибавлением группы СН2. Углеводороды нормального строения кипят при более высокой температуре, чем их изомеры. Перемещение двойной связи в центр молекулы повышает температуру кипения. Цис-изомеры кипят при более высокой температуре, чем транс-изомеры.
Температура плавления в гомологическом ряду повышается. Транс-изомеры алкенов плавятся при меньших температурах, чем цис- изомеры.
Плотность алкенов 0,6-0,8 г/см3.
Растворимость в воде мала, но алкены хорошо растворяются в растворах некоторых солей тяжелых металлов, образуя комплексные соли. Они растворимы в неполярных растворителях: бензоле, хлороформе.
Алкены не имеют запаха. Только у этилена сладковатый запах. Соединения бесцветны, малотоксичны.
3.2. Общая характеристика химических свойств
Характерной особенностью строения алкенов является наличие двойной связи углерод-углерод, а характерными реакциями алкенов – реакции по этой двойной связи, которая состоит из прочной σ-связи и менее прочной π-связи. Следовательно, можно ожидать, что реакции будут включать разрыв этой π-связи и образование вместо нее двух простых σ-связей.
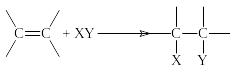
Реакции, в которых происходит соединение двух молекул с образованием одной молекулы нового вещества, называются реакциями присоединения.
Типичными для алкенов являются реакции электрофильного присоединения. В этих реакциях двойная углерод-углеродная связь служит донором электронов. Алкены реагируют с соединениями, которые обеднены электронами и называются электрофильными реагентами (от греческого: любящие электрон).
По двойной связи алкены могут вступать в реакции свободно-радикального присоединения.
Кроме того, алкены, содержащие алкильные группы, вступают в реакции радикального замещения, характерные для алканов. Они способны также к реакциям окисления и полимеризации.
Реакционная способность алкенов выше, чем у алканов, потому что электроны двойной связи являются более “доступными” для атаки реагентов, чем -электроны алканов.
