
- •Строение, номенклатура, изомерия алканов
- •1.2. Характеристика σ – связи
- •1.3. Гомологический ряд алканов
- •1.4. Номенклатура предельных углеводородов
- •1.5. Структурная изомерия алканов
- •1.6. Стереоизомерия (конформационная или поворотная изомерия)
- •2. Способы получения алканов
- •2.1. Промышленные способы получения алканов
- •1) Фракционная перегонка и крекинг нефти.
- •2) Гидрирование угля.
- •2.2. Лабораторные способы получения алканов
- •4) Гидролиз реактива Гриньяра.
- •5) Разложение солей карбоновых кислот.
- •3. Свойства алканов
- •3.1. Физические свойства
- •3.2. Общая характеристика химических свойств
- •3.3. Основные химические реакции
- •1) Галогенирование (реакция металлепсии)
- •2) Нитрование (реакция м.И. Коновалова, 1888 г.)
- •3) Сульфирование
- •4) Сульфохлорирование
- •5) Горение алканов (окисление)
- •4. Отдельные представители алканов
- •5. Экологические аспекты химии алканов
- •6. Вопросы и задачи по теме «алканы»
- •Литература
- •Редактор л.А. Скворцова
2) Нитрование (реакция м.И. Коновалова, 1888 г.)
Другой промышленно важной реакцией является нитрование алканов с образованием нитропарафинов. Реакция обычно проводится в газовой фазе при повышенных температурах с использованием в качестве нитрующего агента азотной кислоты или оксида азота (IV).
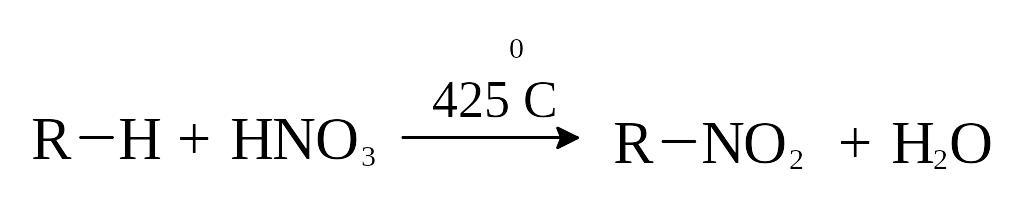
Реакция протекает по свободно-радикальному механизму. По-видимому, первым актом реакции нитрования является дегидратация азотной кислоты с образованием оксида азота (V) и диссоциацией последнего на радикалы:
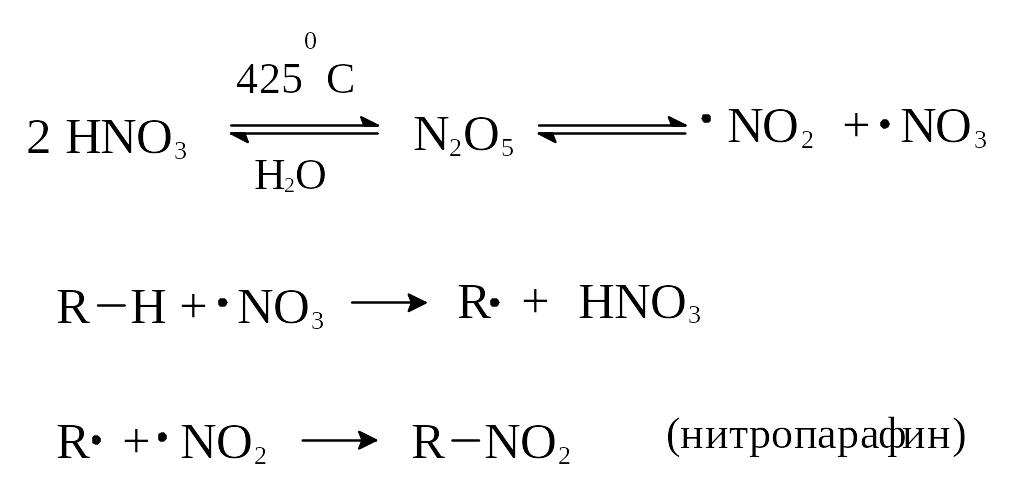
Для реакции нитрования действуют рассмотренные ранее обычные правила замещения, т.е. начиная с пропана образуется смесь нитропарафинов, причем водород у третичного атома углерода замещается легче, чем у вторичного.
На реакцию нитрования расходуется около 40% азотной кислоты. Остальная кислота действует как окислитель, поэтому наряду с нитросоединениями в этом процессе получаются и различные кислородсодержащие соединения - спирты, альдегиды, кетоны, кислоты. Кроме того, образуются непредельные углеводороды.
М.И. Коновалов (1899) впервые проводил эту реакцию с 10-25% азотной кислотой в запаянной трубке при 140-1500 С.
3) Сульфирование
При обычной температуре алканы не взаимодействуют с серной кислотой. При нагревании они вступают в химическую реакцию с дымящейся серной кислотой (олеумом). При этом истинным сульфирующим агентом является не серная кислота, а серный ангидрид. Механизм реакции – свободно-радикальный.
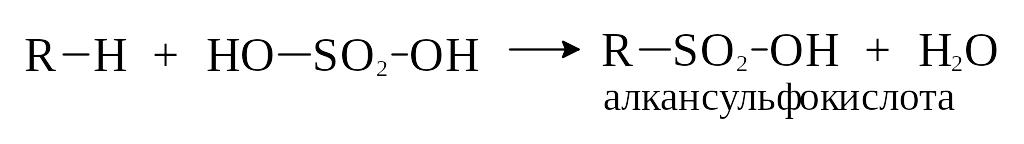
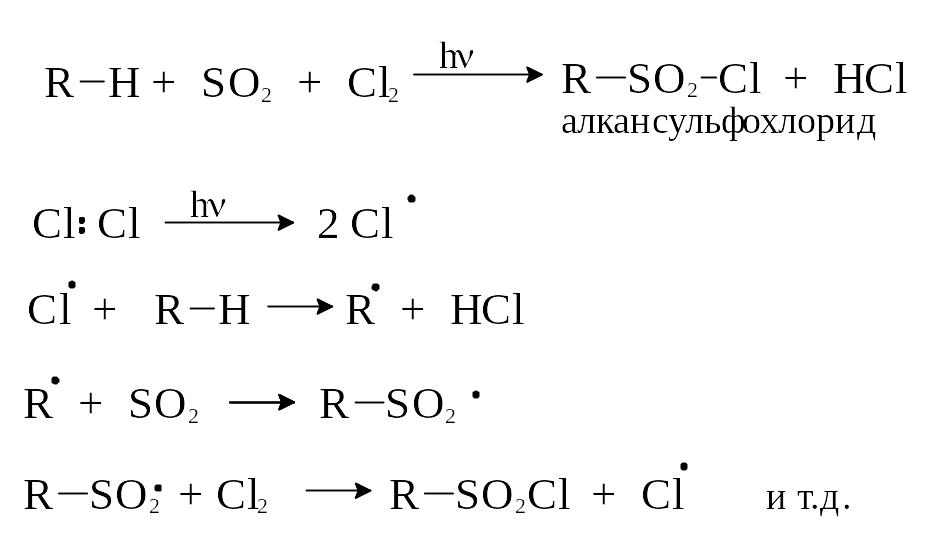
4) Сульфохлорирование
Для сульфохлорирования используют сернистый ангидрид и хлор. Реакция идет по механизму радикального замещения:
Подобно сульфохлорированию протекает реакция сульфоокисления:
![]()
Сульфопроизводные высших предельных углеводородов применяются в качестве моющих средств.
5) Горение алканов (окисление)
Реакция алканов с кислородом, приводящая к образованию диоксида углерода, воды и, что наиболее важно, выделению тепла, является основной реакцией, происходящей в двигателе внутреннего сгорания. Ее огромное практическое значение очевидно.
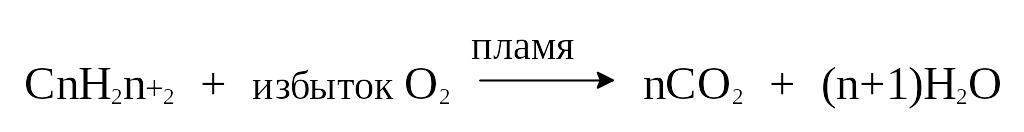
Это свободно-радикальная цепная реакция. Реакция экзотермична, но для того, чтобы она началась, требуется высокая температура - температура пламени.
4. Отдельные представители алканов
Метан содержится в растворенном состоянии в нефти, в попутных газах нефтяных месторождений. Является основным компонентом (97%) природного газа. Газ без цвета и запаха, мало растворим в воде, несколько больше - в диэтиловом эфире. Горит бледным синеватым пламенем. Служит важным промышленным сырьем для получения ацетилена, галогенометанов, формальдегида, метанола, нитрометана, сероуглерода, циановодорода, а также сажи для резинотехнической промышленности. Широко используется в качестве топлива, поскольку имеет большую теплотворность (-50 000 кДж/кг).
Этан содержится в растворенном состоянии в нефти, попутных газах нефтяных месторождений, газообразных продуктах крекинга и пиролиза нефти. Газ без цвета и запаха, почти нерастворим в воде, но растворяется в этаноле. Горит слабо светящимся пламенем. Температура самовоспламенения - 472°С. При 600-650°С в отсутствие катализатора подвергается крекингу с образованием этилена и водорода, которые широко используются в промышленном органическом синтезе. Обладает слабым наркотическим действием.
Пропан содержится в попутных газах нефтяных месторождений и в природном газе, образуется при крекинге нефти. Газ без цвета и запаха, мало растворим в воде и этаноле, но растворим в диэтиловом эфире. Горит слабо светящимся пламенем. Применяется как газообразное и сжиженное горючее. Т.воспл. 466 °С. Применяется в производстве этилена, пропилена, нитрометана и технического углерода. Служит хладоагентом и пропеллентом для аэрозольных упаковок.
