
- •Строение, номенклатура, изомерия алканов
- •1.2. Характеристика σ – связи
- •1.3. Гомологический ряд алканов
- •1.4. Номенклатура предельных углеводородов
- •1.5. Структурная изомерия алканов
- •1.6. Стереоизомерия (конформационная или поворотная изомерия)
- •2. Способы получения алканов
- •2.1. Промышленные способы получения алканов
- •1) Фракционная перегонка и крекинг нефти.
- •2) Гидрирование угля.
- •2.2. Лабораторные способы получения алканов
- •4) Гидролиз реактива Гриньяра.
- •5) Разложение солей карбоновых кислот.
- •3. Свойства алканов
- •3.1. Физические свойства
- •3.2. Общая характеристика химических свойств
- •3.3. Основные химические реакции
- •1) Галогенирование (реакция металлепсии)
- •2) Нитрование (реакция м.И. Коновалова, 1888 г.)
- •3) Сульфирование
- •4) Сульфохлорирование
- •5) Горение алканов (окисление)
- •4. Отдельные представители алканов
- •5. Экологические аспекты химии алканов
- •6. Вопросы и задачи по теме «алканы»
- •Литература
- •Редактор л.А. Скворцова
3.2. Общая характеристика химических свойств
Алканы отличает незначительная реакционная способность. При обычных (нормальных) условиях алканы инертны по отношению к кислотам (соляная или серная), щелочам (едкий натр или едкое кали), окислителям (перманганат калия или бихромат натрия), восстановителям (хлорид олова (II) или металлический натрий).
Однако все насыщенные углеводороды при повышении температуры вступают в химические превращения. Для алканов возможны две принципиально отличные друг от друга схемы химических превращений: реакции с разрывом связи углерод-углерод (С-С связь) и реакции с разрывом связи углерод-водород (С-Н). При сравнении энергии связи углерод-водород (413,7 кДж/моль) и углерод-углерод (350 кДж/моль) в молекуле этана видно, что для разрыва связи углерод-водород требуется затрата большего количества энергии. Тем не менее, для алканов наиболее характерны реакции замещения за счет разрыва связи углерод-водород. Это связано с тем, что углерод-водородные связи в молекуле пространственно более доступны реагентам. Т.е. реакции, идущие с разрывом связи углерод-углерод, энергетически менее выгодны, чем реакции с разрывом связи углерод-водород.
Наиболее характерными реакциями для алканов являются реакции замещения атомов водорода: галогенирования, нитрования, сульфирования и реакции внедрения. Реакции замещения в алканах обычно идут по радикальному механизму SR.
3.3. Основные химические реакции
1) Галогенирование (реакция металлепсии)
Реакция галогенирования – это замещение атомов водорода на атомы галогенов. Алканы могут вступать в реакцию со всеми галогенами, но скорость реакций зависит от реакционной способности галогена, которая изменяется в ряду:
F > Cl > Br > J
Реакция с фтором экзотермична (435,4 кДж/моль) и идет со взрывом. Иодирование алканов происходит очень трудно и не идет до конца.
В общем виде реакция галогенирования:

Галогенирование алканов осуществляется по радикальному механизму, который часто называют цепным механизмом, а сами реакции - цепными реакциями. Различают три стадии цепного механизма: инициирование цепи, развитие цепи (рост цепи), обрыв цепи.
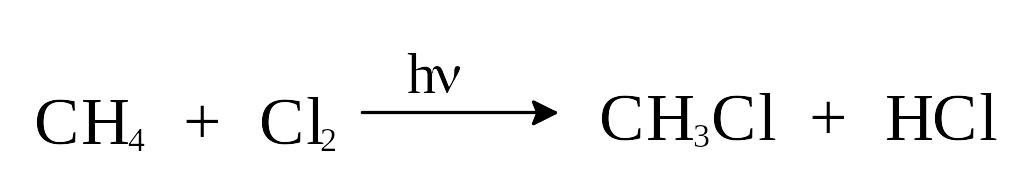
Механизм галогенироания алканов рассмотрим на примере хлорирования простейшего алкана - метана.
1-я стадия - инициирование цепи, или появление свободных радикалов хлора происходит под действием кванта света.
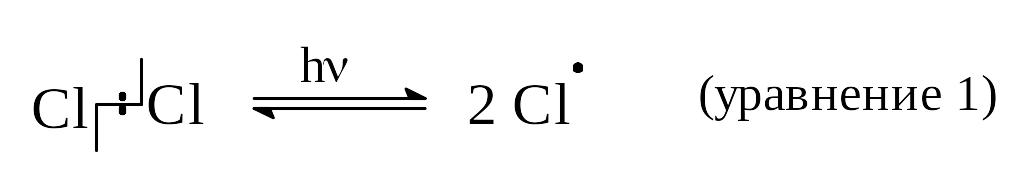
Образовавшиеся радикалы (атомы) хлора (а их требуется совсем немного) способны начать вторую стадию.
2-я стадия - стадия роста цепи. На каждом этапе этой стадии происходит исчезновение одной реакционноспособной частицы и появление другой; в данном случае это реакция радикалов хлора и метана (уравнение 2) и метильных радикалов с хлором (уравнение 3).

Важной особенностью второй стадии является то, что вместо радикала хлора, расходуемого на первом этапе второй стадии, появляется другой на втором этапе, т.е. реагенты превращаются в продукты реакции, а радикалы в процессе не исчезают. Со стадиями роста цепи конкурируют стадии обрыва цепи, заключающиеся в исчезновении радикалов.
3-я стадия - обрыв цепи - происходит при уничтожении "ведущего" радикала в результате взаимодействия с другой радикальной частицей. В случае хлорирования метана это возможно при соединении двух реакционноспособных частиц (уравнения 4,5,6) или при их адсорбции на поверхности реакционного сосуда.

При определенных условиях на каждый квант (фотон) поглощенного света образуется около 10 000 молекул хлористого метила. Фотон разрывает связь в одной молекуле хлора с образованием двух атомов хлора, каждый из которых начинает цепь. В среднем каждая цепь состоит из 5 000 повторений цикла, прежде чем она обрывается. Хлорирование метана не останавливается на стадии образования хлористого метила, можно получить также продукты более глубокого хлорирования: дихлорметан (хлористый метилен), трихлорметан (хлороформ) и тетрахлорметан (четыреххлористый углерод).
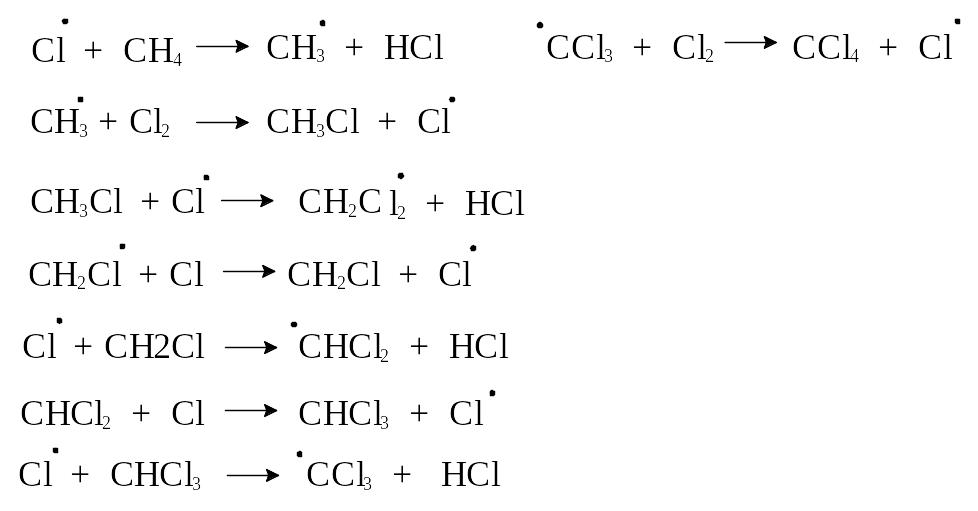
Таким образом, в результате галогенирования метана образуются всевозможные продукты замещения, относительные количества их зависят от количественного соотношения хлора и метана.

Это свидетельствует о способности всех водородных атомов подвергаться замещению. Установлено, что реакционная способность водорода зависит от того, является ли он первичным, вторичным или третичным, а не от алкана, в котором он находится. Легкость отщепления водородных атомов уменьшается в ряду:
третичный > вторичный > первичный > СН4
Эта последовательность справедлива:
а) для различных атомов водорода в одном радикале (определяет направление реакции);
б) для атомов водорода различных алканов (определяет относительную реакционную способность).
