
- •Строение, номенклатура, изомерия алканов
- •1.2. Характеристика σ – связи
- •1.3. Гомологический ряд алканов
- •1.4. Номенклатура предельных углеводородов
- •1.5. Структурная изомерия алканов
- •1.6. Стереоизомерия (конформационная или поворотная изомерия)
- •2. Способы получения алканов
- •2.1. Промышленные способы получения алканов
- •1) Фракционная перегонка и крекинг нефти.
- •2) Гидрирование угля.
- •2.2. Лабораторные способы получения алканов
- •4) Гидролиз реактива Гриньяра.
- •5) Разложение солей карбоновых кислот.
- •3. Свойства алканов
- •3.1. Физические свойства
- •3.2. Общая характеристика химических свойств
- •3.3. Основные химические реакции
- •1) Галогенирование (реакция металлепсии)
- •2) Нитрование (реакция м.И. Коновалова, 1888 г.)
- •3) Сульфирование
- •4) Сульфохлорирование
- •5) Горение алканов (окисление)
- •4. Отдельные представители алканов
- •5. Экологические аспекты химии алканов
- •6. Вопросы и задачи по теме «алканы»
- •Литература
- •Редактор л.А. Скворцова
2) Гидрирование угля.
Гидрирование (насыщение водородом) каменного и бурого угля происходит под действием водорода в присутствии катализатора (оксиды и сульфиды молибдена, вольфрама, никеля) при высоких температурах 450-5000С. Процесс проводят в специальных реакторах – автоклавах, выдерживающих давление водорода до 300 атм. Уголь растирают в тонкий порошок и суспендируют в органическом растворителе (продуктах переработки нефти), добавляют катализатор. Смесь помещают в автоклав, вводят водород под давлением и нагревают. Этот процесс называют методом сжижения угля. В результате него получают смесь различных алканов и циклоалканов, которые используются в качестве моторного топлива.

3) Синтез из оксида углерода (Фишер).
Алканы получают при каталитическом гидрировании оксида углерода при температуре 180…3000С. В качестве катализатора используют кобальт-торий - магниевую смесь:

В зависимости от условий процесса и катализатора получают различные продукты реакции. В основном образуются алканы неразветвленные и с небольшой молекулярной массой, их смесь называют "синтин" (синтетический бензин).
2.2. Лабораторные способы получения алканов
1) Каталитическое гидрирование непредельных углеводородов.

Образуются углеводороды с тем же числом углеродных атомов и с тем же строением цепи. Метод ограничен только доступностью алкенов.
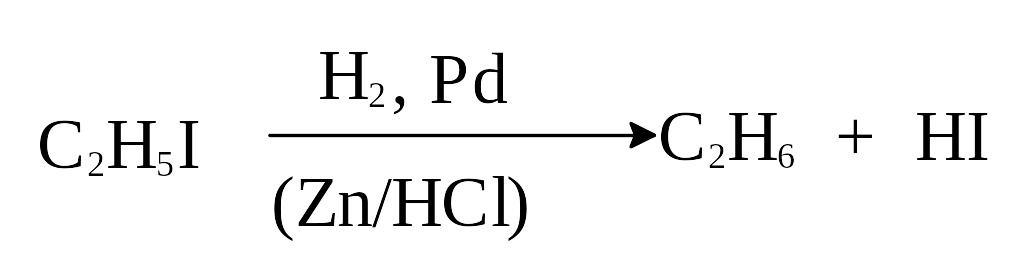
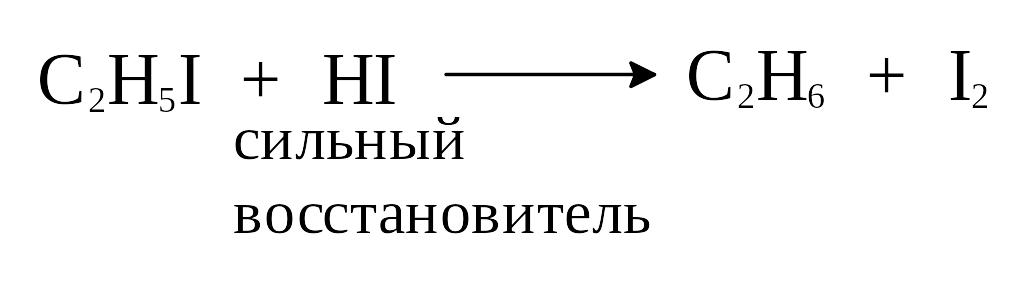
2) Восстановление алкилгалогенидов.
Предельные углеводороды могут быть получены восстановлением галогенпроизводных углеводородов каталитически возбужденным водородом, водородом в момент выделения или с помощью восстановителей, например, иодистого водорода:
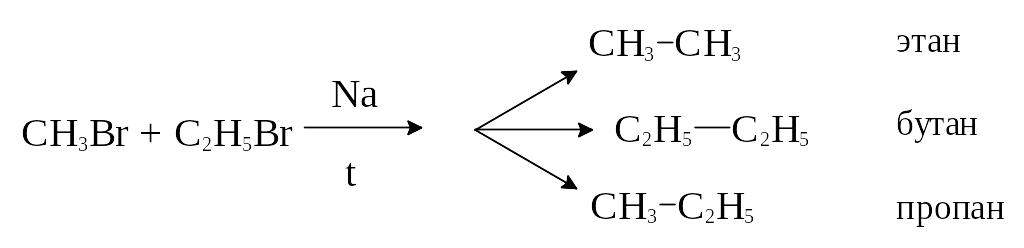
3) Действие металлического натрия на галоидные алкилы (реакция Вюрца).
Реакцию используют для увеличения длины углеводородной цепи алканов. В качестве исходных соединений служат галоидные алкилы соединений с меньшим числом атомов углерода, на которые действуют металлическим натрием. Реакция идет при нагревании.
Особенности реакции: если брать в реакцию два галоидных алкила, то получается смесь трех углеводородов, разделить которые не всегда возможно, поэтому смеси галоидных алкилов вводят в реакцию Вюрца редко.
Вместо натрия можно использовать другие металлы: Li, Mg, Zn. Лучшие результаты дает метод синтеза алканов с использованием литийорганических соединений и солей меди (реакция Кори-Хауса).
4) Гидролиз реактива Гриньяра.
При взаимодействии галогенпроизводного углеводорода с магнием образуется магнийорганическое соединение (реактив Гриньяра), при последующем гидролизе которого получается предельный углеводород.
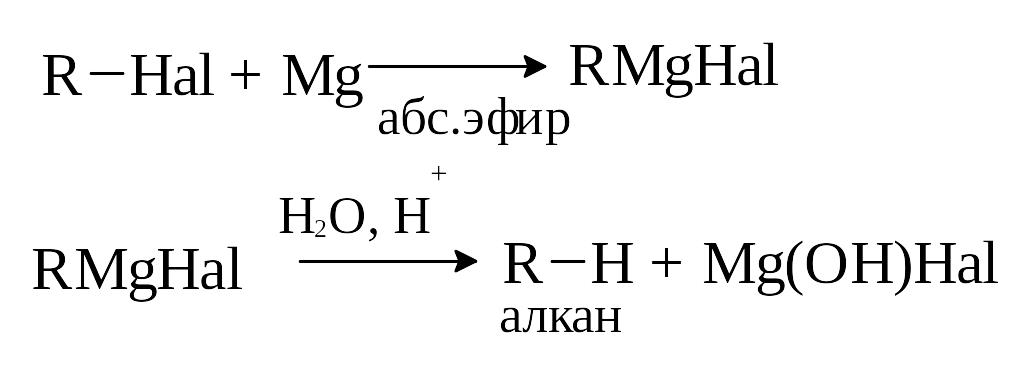
5) Разложение солей карбоновых кислот.
При нагревании солей карбоновых кислот с едкими щелочами происходит их декарбоксилирование (отщепление СО2) и образуются предельные углеводороды с меньшим числом углеродных атомов, чем в исходной кислоте. При взаимодействии ацетата натрия со щелочью образуется метан.
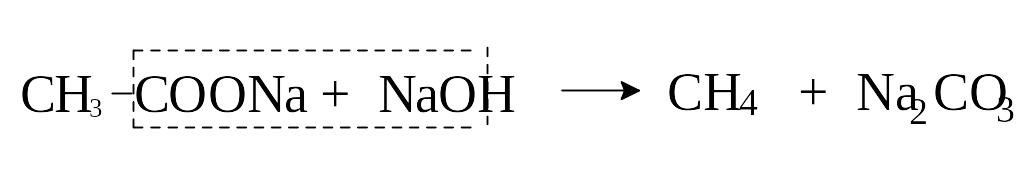
3. Свойства алканов
3.1. Физические свойства
Физические свойства предельных углеводородов, как и других органических соединений, определяются их составом и строением.
Первые четыре углеводорода гомологического ряда при нормальных условиях - газы, далее следуют жидкости (С5 - С17) и начиная с С18 - твердые вещества. За исключением низших алканов, температуры их кипения повышаются на 20-300С с увеличением длины цепи на один атом углерода. Тенденция сохраняется для других гомологических рядов.
Для температуры плавления такая закономерность отсутствует, поскольку межмолекулярные силы в кристалле зависят от размера молекул и от того, как они упакованы в кристаллической решетке.
Разница в температурах кипения алканов, содержащих одинаковое число атомов углерода, но имеющих различное строение, несколько меньше. В каждом случае изомер с разветвленной цепью имеет более низкую температуру кипения, чем изомер с прямой цепью. И, кроме того, чем больше разветвлений, тем ниже температура кипения. Так, бутан кипит при 00С, а изобутан - при -120С; н-пентан кипит при 360С, изопентан - при 280С, а неопентан - при 9,50С. Подобная зависимость наблюдается для всех классов органических соединений.
В соответствии с эмпирическим правилом "подобное растворяется в подобном", алканы растворимы в неполярных растворителях, таких как бензол, эфир, хлороформ, и нерастворимы в воде и других сильнополярных растворителях. При использовании алканов в качестве растворителей следует помнить, что они растворяют малополярные соединения и не растворяют сильнополярные.
Плотность возрастает с увеличением числа углеродных атомов, но не превышает значения 0,8; таким образом, все алканы легче воды.
Чистые парафины бесцветны и почти лишены запаха. Вдыхание паров легкокипящих углеводородов оказывает слабое наркотическое (усыпляющее) действие, в больших дозах может привести к летальному исходу из-за кислородной недостаточности.
