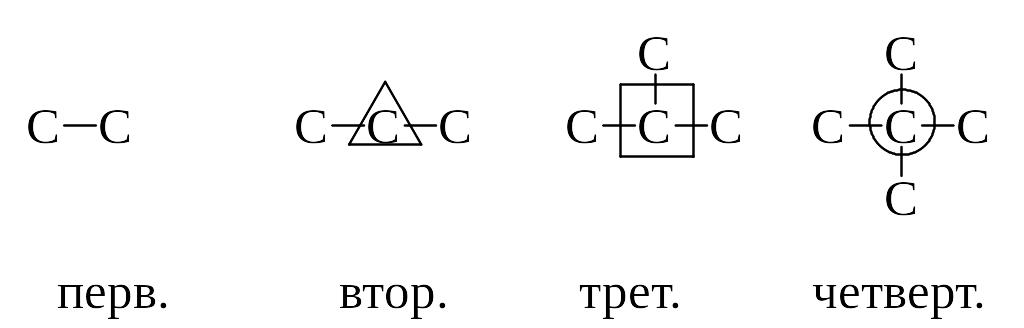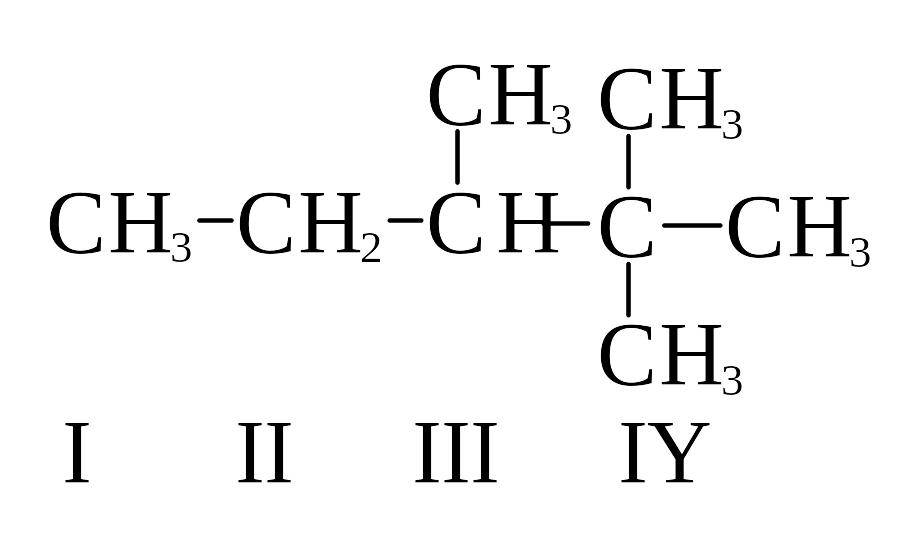- •Строение, номенклатура, изомерия алканов
- •1.2. Характеристика σ – связи
- •1.3. Гомологический ряд алканов
- •1.4. Номенклатура предельных углеводородов
- •1.5. Структурная изомерия алканов
- •1.6. Стереоизомерия (конформационная или поворотная изомерия)
- •2. Способы получения алканов
- •2.1. Промышленные способы получения алканов
- •1) Фракционная перегонка и крекинг нефти.
- •2) Гидрирование угля.
- •2.2. Лабораторные способы получения алканов
- •4) Гидролиз реактива Гриньяра.
- •5) Разложение солей карбоновых кислот.
- •3. Свойства алканов
- •3.1. Физические свойства
- •3.2. Общая характеристика химических свойств
- •3.3. Основные химические реакции
- •1) Галогенирование (реакция металлепсии)
- •2) Нитрование (реакция м.И. Коновалова, 1888 г.)
- •3) Сульфирование
- •4) Сульфохлорирование
- •5) Горение алканов (окисление)
- •4. Отдельные представители алканов
- •5. Экологические аспекты химии алканов
- •6. Вопросы и задачи по теме «алканы»
- •Литература
- •Редактор л.А. Скворцова
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Саратовский государственный технический университет
АЛКАНЫ
Методические указания
для подготовки к занятиям по дисциплине «Органическая химия»
для студентов специальности 02080165 «Экология»
Одобрено
редакционно-издательским советом
Саратовского государственного
технического университета
Саратов 2007
ВВЕДЕНИЕ
Углеводородами называют органические соединения, состоящие из атомов двух элементов - углерода и водорода.
Алифатические (алициклические) углеводороды - органические вещества с открытой (прямой или разветвленной) цепью углеродных атомов. Общее название алифатических соединений происходит от греческого слова «алефар» - жир, поскольку впервые структуры с длинными углеродными цепями были обнаружены в составе жира. Поэтому алифатические углеводороды еще называют соединениями жирного ряда.
Алифатические углеводороды подразделяются на «насыщенные» и «ненасыщенные» в зависимости от соотношения атомов углерода и водорода в их молекулах.
Насыщенные углеводороды вследствие их низкой реакционной способности называют парафинами (от латинского parum affenis - малое сродство). Другое название - предельные углеводороды - указывает на то, что атомы углерода в них максимально насыщены атомами водорода. В соответствии с систематической номенклатурой насыщенные углеводороды называются алканы.
Ненасыщенные углеводороды – это соединения, в молекулах которых два или несколько атомов углерода связаны между собой кратными (двойными или тройными) связями. В зависимости от характера межуглеродных кратных связей и их количества непредельные углеводороды делятся на три класса:
1) этиленовые (алкены);
2) ацетиленовые (алкины);
3) диеновые (алкадиены).
Строение, номенклатура, изомерия алканов
Общая формула алканов: СnH2n+2.
В алканах все атомы углерода находятся в sp3-гибридизации, все связи между атомами – одинарные σ-связи.
1.1. sp3–Гибридзация
sp3–Гибридное состояние четырехвалентного атома углерода в насыщенных соединениях возникает при комбинации одной 2s – орбитали и трех 2p–орбиталей, на каждой из которых находится по одному электрону. Образуется четыре sp3–гибридные орбитали, которые направлены в пространстве к вершинам тетраэдра. Угол между осями sp3-орбиталей составляет 10928. Такая пространственная конфигурация называется тетраэдрической. Из квантово-механических расчетов следует, что sp3–орбиталь имеет форму, близкую к p–орбитали, но является несимметричной, причем ее доля с большей электронной плотностью направлена к вершине тетраэдра.
Таким образом, тип гибридизации определяет геометрию образующейся молекулы.
Ф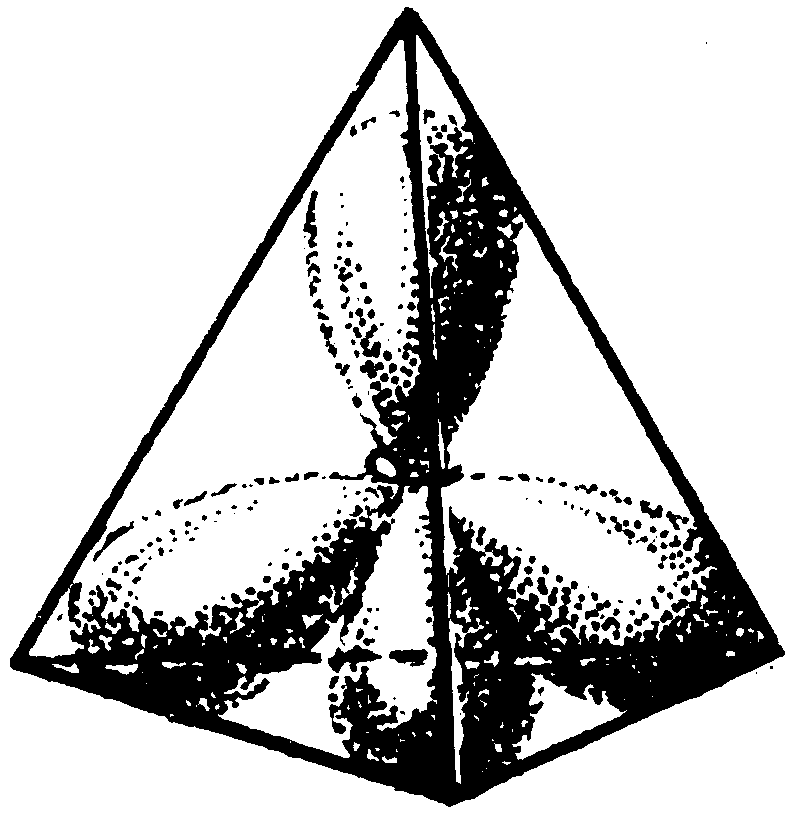 орма
– sp3
гибридной орбитали Тетраэдрическая
конфигурация
орма
– sp3
гибридной орбитали Тетраэдрическая
конфигурация
атома углерода
1.2. Характеристика σ – связи
Связи, которые образуют атомы углерода в sp3–гибридизации, называются σ-связями. Их еще называют простыми или одинарными связями, а электроны, их образующие - σ-электронами. σ-Связь между атомами углерода образуется при перекрывании их гибридных орбиталей, которые имеют одинаковую симметрию и близкие энергии, поэтому максимум электронной плотности находится на прямой, соединяющей центры этих атомов.
σ-Cвязь имеет следующие характеристики:
1) Длина С-С связи 0,154 нм.
2) Энергия, необходимая для разрыва С-С связи, Е С-С = 357 кДж/моль.
3) Полярность связи зависит от природы атомов, которые ее образуют.
Если это атомы с одинаковыми или близкими значениями электроотрицательности, то связь - неполярная, максимум электронной плотности находится на равном расстоянии от центров атомов. Если σ-связь образована атомами с разной электроотрицательностью, то она является полярной; максимум электронной плотности смещен в сторону более электроотрицательного атома. У последнего в результате смещения электронной плотности возникает частичный (или дробный) отрицательный заряд, обозначаемый δ-, соответственно у другого атома - дробный положительный заряд, обозначаемый δ+. Смещение электронной плотности по σ-связи называется индуктивным эффектом (Iэф).
4) Поляризуемость (динамическая поляризация) связи – способность к смещению электронов под действием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Чем больше размер атома, тем больше поляризуемость.
5) Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
1.3. Гомологический ряд алканов
Простейшим представителем предельных углеводородов является метан - СН4. Остальные можно рассматривать как производные метана, у которого атомы водорода замещены на углеводородные остатки.
В ряду предельных углеводородов каждый последующий член ряда отличается от предыдущего на группу СН2, которая называется гомологической разностью:
СН4 СН4 метан
СН3-СН3 С2Н6 этан
СН3-СН2-СН3 С3Н8 пропан
СН3-СН2-СН2-СН3 С4Н10 бутан
СН3-СН2-СН2-СН2-СН3 С5Н12 пентан
СН3-СН2-СН2-СН2-СН2-СН3 С6Н14 гексан
СН3-СН2-СН2-СН2-СН2-СН2-СН3 С8Н18 октан
СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН3 С9Н20 нонан
СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН3 С10Н22 декан
Ряд соединений, строение которых последовательно изменяется на группу СН2 и которые имеют сходные химические свойства, называется гомологическим рядом. Отдельные члены ряда называются гомологами.
Предельные углеводороды называют еще гомологическим рядом метана - по названию простейшего представителя.
Алканы могут иметь неразветвленную или разветвленную углеродные цепи. В зависимости от количества углерод-углеродных связей различают атомы углерода: первичные, имеющие одну углерод-углеродную связь, вторичные - две связи, третичные - три, четвертичные – четыре.