
- •Начала квантовой химии и строение молекул
- •Решаемые задачи:
- •Модель Томсона (1904 г.)
- •Взаимное расположение электронов в атоме
- •Х. Гейгер и е. Марсден (1906-1909 г.)
- •Планетарная модель атома:
- •Серия Бальмера в спектре атома водорода (снизу указаны длины волн соответствующих линий в нм).
- •II. Способность атома поглощать и испускать излучение подчиняется закону, по которому излучение, связанное с переходом, должно быть монохроматическим и иметь частоту ν, определяемую соотношением
- •Зависимость силы анодного тока в цепи от ускоряющей разности потенциалов eVа.
- •Некоторые допустимые решения волнового уравнения для одномерных колебаний натянутой струны.
- •УравнениеШредингера
- •Решение уравнения Шредингера для простейших модельных систем
- •Квантовое число m может принимать значения
- •Спиновые квантовые числа некоторых элементарных частиц и атомных ядер.
- •Физический смысл квантовых чисел электрона
- •1. Размеры орбитали.
- •2. Энергию электронов, находящихся на орбитали.
- •Радиальное распределение для орбиталей атома водорода.
- •Теория и методы описания химической связи и строения молекул Метод валентных связей
- •В молекуле н2.
- •Зависимость полной энергии молекулы водорода от межъядерного расстояния
- •Результаты теоретических и экспериментальных определений энергии и длины связи в молекуле н2
- •Основные принципы метода
- •1. Перекрывающиеся ао должны иметь близкие энергии.
- •2. Взаимодействующие ао должны перекрываться в значительной области пространства.
- •3. Ао должны обладать одинаковыми свойствами симметрии относительно оси связи в молекуле.
- •Изменение значений scc в зависимости от межатомного расстояния с─с
- •Водородоподобные.
- •Слетеровские функции (sto).
- •Гауссовские функции (gto). Наименьшие базисные наборы, обеспечивающие описание
- •Число кулоновскихинтеграллов для молекуле пропана, возникающих в различных методах расчета.
- •Сравнительная характеристика полуэмпирических методов.
- •Indo – Intermediate Neglect of Differential Overlap – частичное пренебрежение дифференциальным перекрыванием.
- •Симметрия молекулярных систем Элементы и операции симметрии
- •Оси и плоскости симметрии куба
- •Плоскости симметрии на примере комплексного иона [CuF4]─.
- •1. Правило соответствия
- •2. Правило ассоциативности группового умножения
- •Квантово-химическое описание реакций Квантовая теория химических реакций Понятие о поверхностях потенциальной энергии.
- •Симметрия и относительная энергия мо бутадиена (а) и этилена (б).
- •Схемы строения переходных комплексов для реакции димеризации этилена и взаимодействия этилена с бутадиеном.
- •Симметрия переходного состояния реакции взаимодействия этилена с бутадиеном
1. Перекрывающиеся ао должны иметь близкие энергии.
2. Взаимодействующие ао должны перекрываться в значительной области пространства.
3. Ао должны обладать одинаковыми свойствами симметрии относительно оси связи в молекуле.
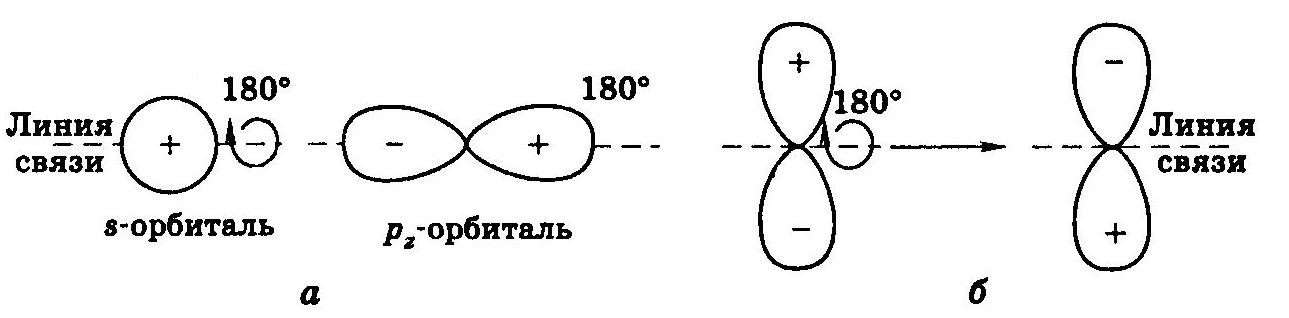
Симметрия атомных орбиталей:
а – симметричные орбитали; б – антисимметричная орбиталь.
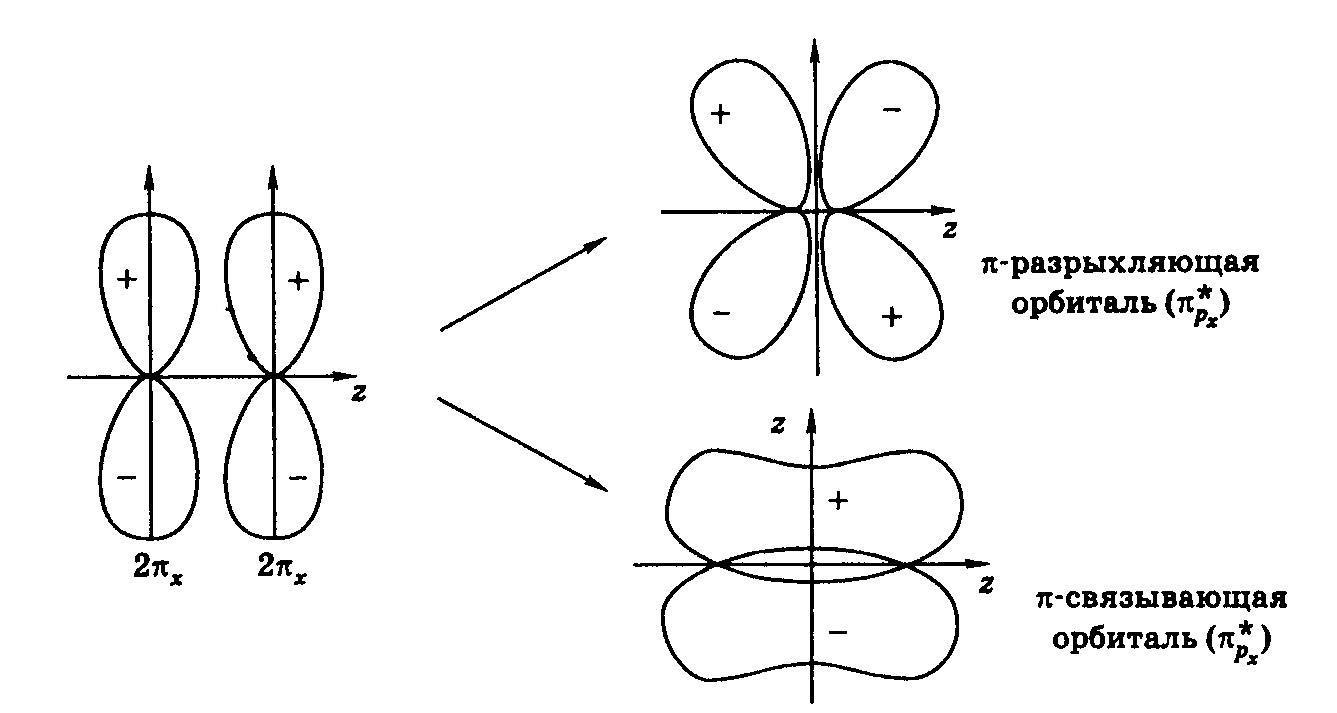
Схема образования π-молекулярных орбиталей.
При комбинации s- или рx- AO возникают σ – орбитали, рy- или рz- AO - π – орбитали (πy или πz). При перекрывании
d – АО в четырех областях пространства образуются δ-МО
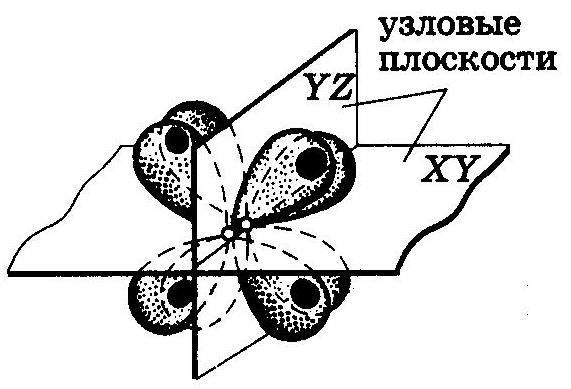
Перекрывание d-АО двух атомов с образованием δ-связи между ними.
[Cr2(CH3COO)4(H2O)2], [Cr2(CH3)8]4─, Re2(SO4)4(H2O)2]2─
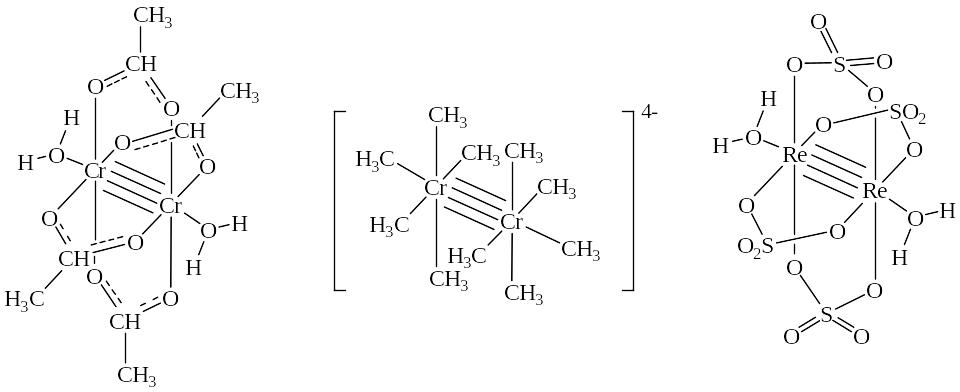
Комплексные соединения с δ-связью
σls и σ*ls.
Порядок связи между двумя атомами равен полуразности чисел электронов на связывающих и разрыхляющих орбиталях:
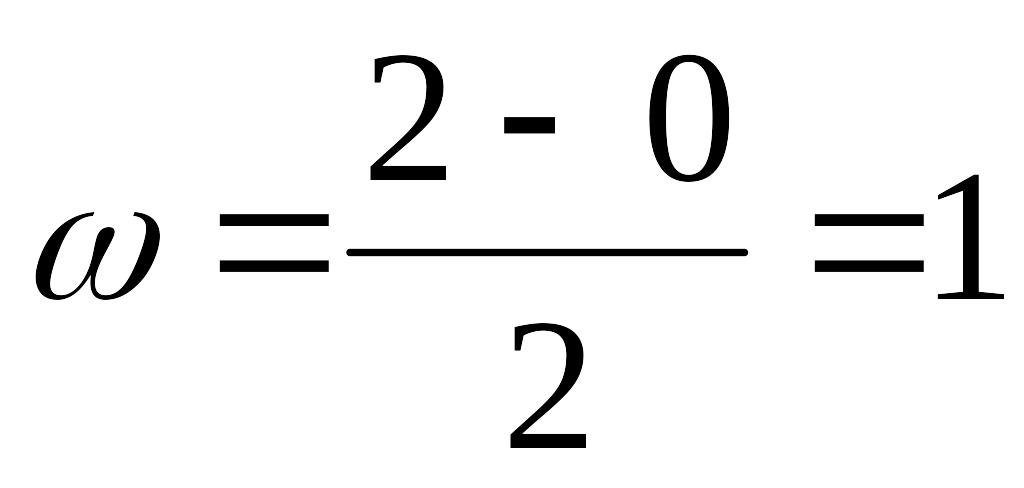
Строение и энергетические диаграммы двухатомных молекул
σ2s < σ*2s < σ2px < π2py = π2pz < π*2py= π*2pz< σ2px
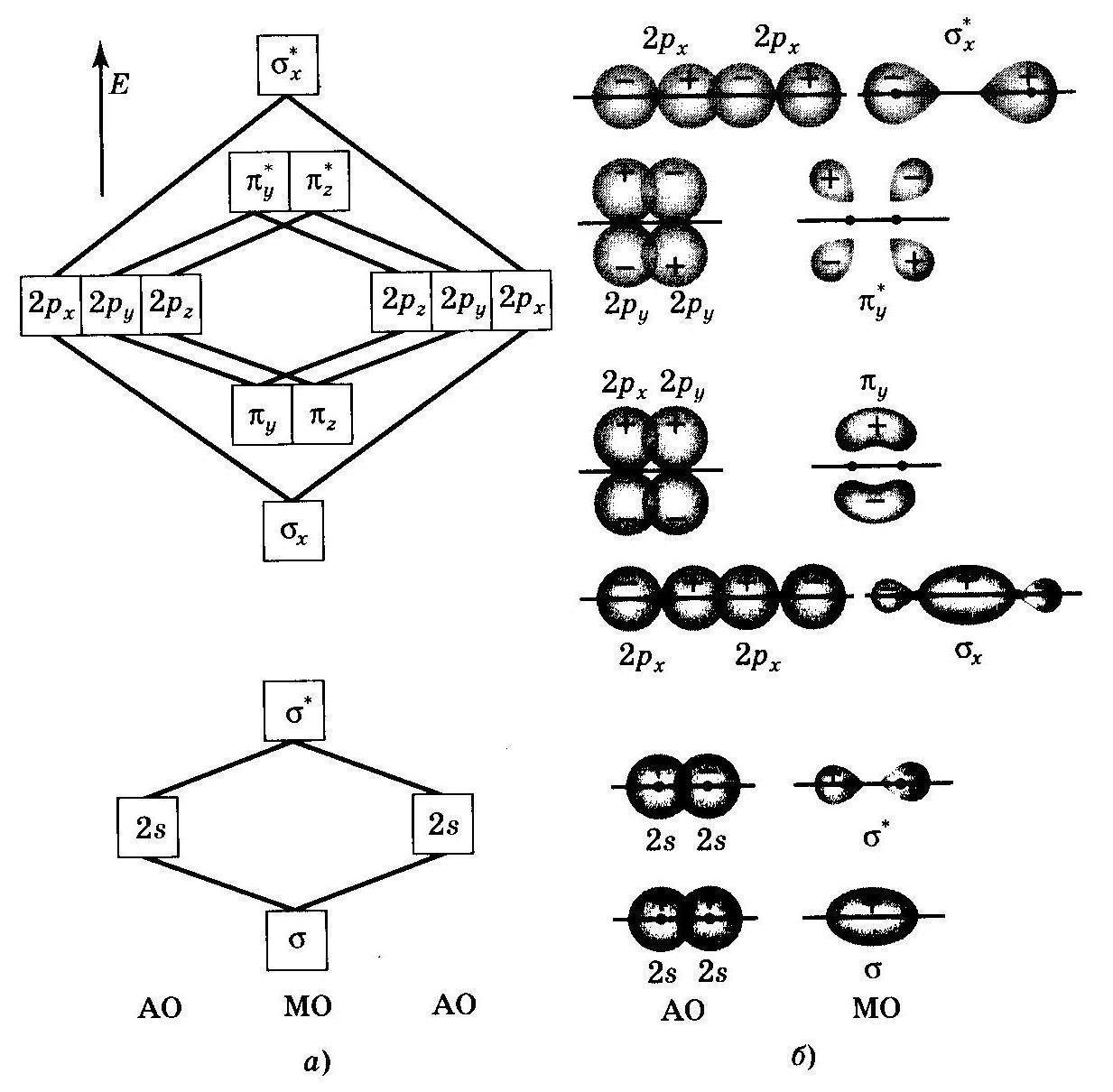
Энергетическая диаграмма расположения атомных АО и молекулярных МО орбиталей (а) и схема образования молекулярных орбиталей (б) из атомных орбиталей
2 Li(2s1) → Li2 (σ 2)
2 Be(2s2) → Be2 (σ 2 σ * 2),
2B[2s22p1]→ В2(σ 2σ *2πy πz)
С2 (σ2σ*2πy2πz2), ω = 2;
N2 (σ2σ*2πy2πz2σx2), ω = 3;
О2 (σ2σ*2σx2πy2πz2πy*πz*), ω = 2;
F2 (σ2σ*2σx2πy2πz2πy*2πz*2), ω = 1;
Ne2 (σ2σ*2σx2πy2πz2πy*2πz*2σx*2), ω = 0 – связь отсутствует.
Порядки, энергии и длины связей для гомоатомных молекул, образованных элементами 2 периода.
Молекула |
Li2 |
B2 |
C2 |
N2 |
O2 |
F2 |
Порядок связи |
1 |
1 |
2 |
3 |
2 |
1 |
Энергия связи, кДж/моль |
105 |
289 |
602 |
941 |
494 |
155 |
Длина связи, нм |
0,267 |
0,159 |
0,124 |
0,110 |
0,121 |
0,142 |
Н 1s1
F ls22s22p5
|
(7.9.) |
|
Справедливы
соотношения
![]() ,
,![]()

Схема образования МО в молекуле фтороводорода.

Контурная диаграмма распределения электронной плотности в молекуле HF. Ядро атома водорода слева.
Многоатомные молекулы
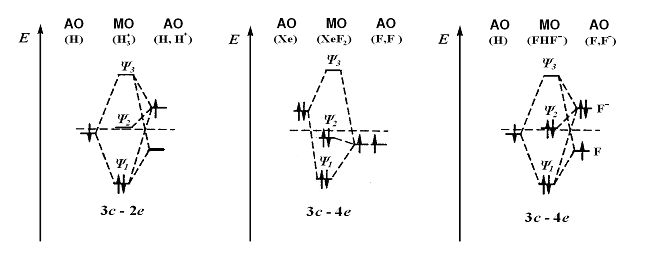
Образование трехцентровых молекулярных орбиталей
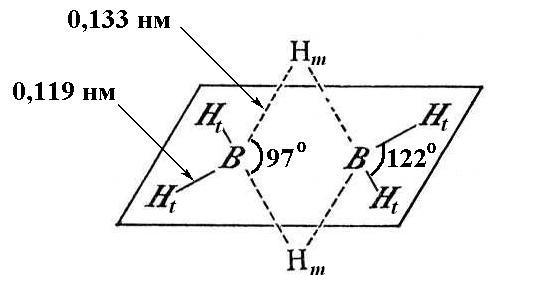
Геометрия молекулы диборана.

Энергетическая диаграмма распределения электронов по МО молекулы диборана
Зонная теория строения кристаллических веществ
1. Ионы в узлах кристаллической решетки считаются неподвижными в силу их сравнительно больших масс.
2. Поведение электронов рассматривается подобно поведению отрицательно заряженных молекул газа, не взаимодействующих друг с другом.
3. Используются упрощенные формулы для рассчета потенциалов ионов.
4. Рассматривается движение одного электрона в постоянном периодическом поле, т. е. по сути дела решается одночастичная задача.
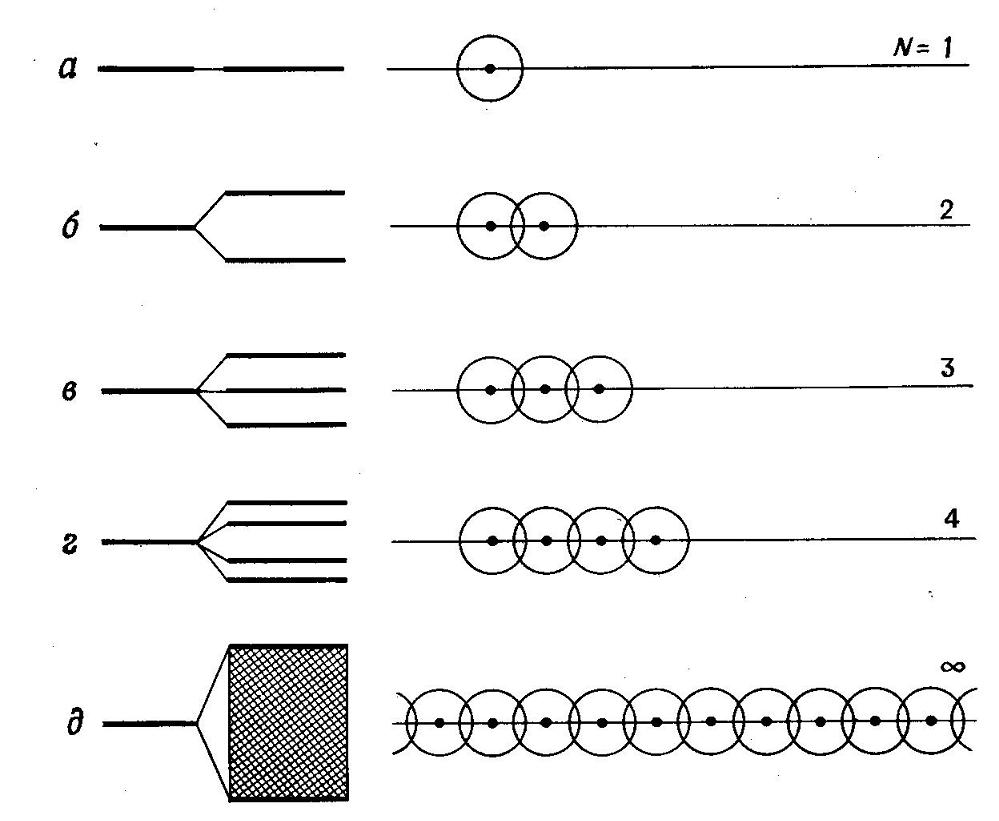
Образование полосы N орбиталей при последовательном
добавлении атомов в линию.
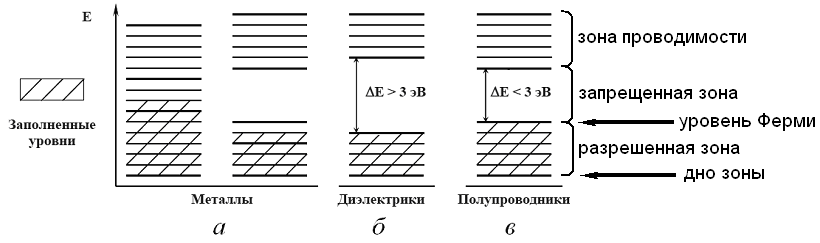
Электронная структура металлов, диэлектриков и полупроводников.
Расчетные методы квантовой химии
Неэмпирические квантово-химические методы
НΨ точн ({r, R}) = ЕΨ точн ({r, R}), |
(10.1.) |
где H – молекулярный гамильтониан, Ψточн({r, R}) – точная молекулярная волновая функция, с помощью которой могут быть рассчитаны все химические свойства молекулы, E – полная энергия молекулы.
Н = Tя(R) + Tэ(r) + Vяя(R) + Vэя(R,r) +Vээ(r) =
|
(10.2.)
|
где:
Tя(R),
Tэ(r),
Vяя(R),
Vэя(R,r),
Vээ(r)
– операторы, описывающие кинетическую
энергию ядер и электронов, энергию
межъядерного, электронно-ядерного и
межэлектронного взаимодействий. Индексы
i, j
относятся к электронам, a,
b – к
ядрам, Mа
и m
– массы ядер и электронов, соответственно,
![]() – постоянная Планка, е
– заряд электрона, Za
, Zв
– заряды
ядер, Rab
– расстояние между ядрами, rai–
расстояние между ядром а
и электроном i,
rij
– расстояние между электронами;
– постоянная Планка, е
– заряд электрона, Za
, Zв
– заряды
ядер, Rab
– расстояние между ядрами, rai–
расстояние между ядром а
и электроном i,
rij
– расстояние между электронами;
![]() и
и
![]() операторы и действующие на координаты
электронов и ядер, соответственно.
операторы и действующие на координаты
электронов и ядер, соответственно.
НэΨэ= ЕэΨэ |
(10.3.) |
|
FΨi=εiΨi |
(10.4.) |
|
где F – оператор Фока, εi – энергии МО.
Ψi = civΨv |
(10.5.) |
Уравнения Рутаана:
|
(10.6.) |
в которых
|
(10.7.) |
где: hiν – остовные интегралы, описывающие энергию электрона в поле атомных ядер; Jiν – двухэлектронные кулоновские интегралы, описывающие энергию электростатического отталкивания электронов, находящихся на орбиталях Ψμ и Ψν; Kiν – обменный интеграл, описывающий понижение энергии взаимодействия электронов с параллельными спинами и расположенных на разных орбиталях; Sμ – интеграл перекрывания между атомными орбиталями μ и показывающий степень их пространственного перекрывания.
|
(10.8.) |
где a0 - боровский радиус (0,0529 нм), Z – эффективный заряд ядра (для атома углерода Z=3,25), R – межатомное расстояние, Å. В табл. 1.10 показано изменение величины SCC в зависимости от расстояния С─С.

