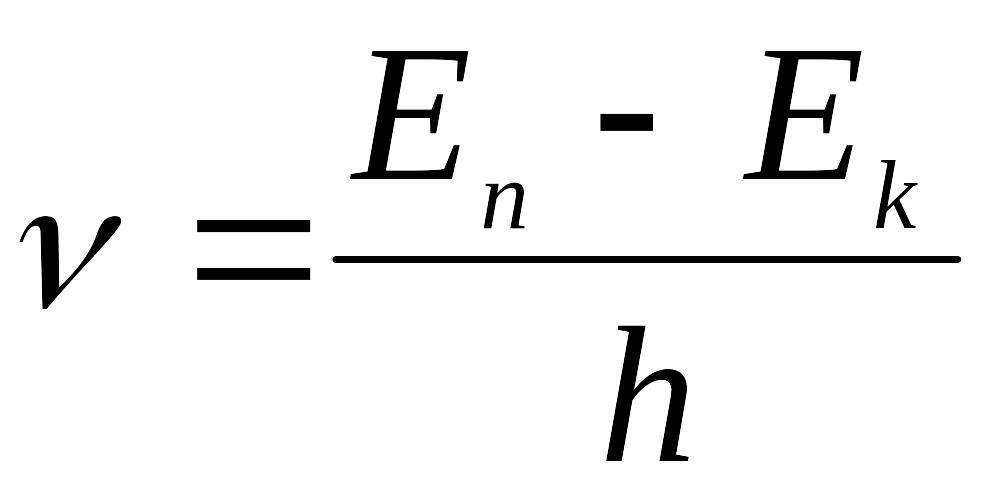- •Начала квантовой химии и строение молекул
- •Решаемые задачи:
- •Модель Томсона (1904 г.)
- •Взаимное расположение электронов в атоме
- •Х. Гейгер и е. Марсден (1906-1909 г.)
- •Планетарная модель атома:
- •Серия Бальмера в спектре атома водорода (снизу указаны длины волн соответствующих линий в нм).
- •II. Способность атома поглощать и испускать излучение подчиняется закону, по которому излучение, связанное с переходом, должно быть монохроматическим и иметь частоту ν, определяемую соотношением
- •Зависимость силы анодного тока в цепи от ускоряющей разности потенциалов eVа.
- •Некоторые допустимые решения волнового уравнения для одномерных колебаний натянутой струны.
- •УравнениеШредингера
- •Решение уравнения Шредингера для простейших модельных систем
- •Квантовое число m может принимать значения
- •Спиновые квантовые числа некоторых элементарных частиц и атомных ядер.
- •Физический смысл квантовых чисел электрона
- •1. Размеры орбитали.
- •2. Энергию электронов, находящихся на орбитали.
- •Радиальное распределение для орбиталей атома водорода.
- •Теория и методы описания химической связи и строения молекул Метод валентных связей
- •В молекуле н2.
- •Зависимость полной энергии молекулы водорода от межъядерного расстояния
- •Результаты теоретических и экспериментальных определений энергии и длины связи в молекуле н2
- •Основные принципы метода
- •1. Перекрывающиеся ао должны иметь близкие энергии.
- •2. Взаимодействующие ао должны перекрываться в значительной области пространства.
- •3. Ао должны обладать одинаковыми свойствами симметрии относительно оси связи в молекуле.
- •Изменение значений scc в зависимости от межатомного расстояния с─с
- •Водородоподобные.
- •Слетеровские функции (sto).
- •Гауссовские функции (gto). Наименьшие базисные наборы, обеспечивающие описание
- •Число кулоновскихинтеграллов для молекуле пропана, возникающих в различных методах расчета.
- •Сравнительная характеристика полуэмпирических методов.
- •Indo – Intermediate Neglect of Differential Overlap – частичное пренебрежение дифференциальным перекрыванием.
- •Симметрия молекулярных систем Элементы и операции симметрии
- •Оси и плоскости симметрии куба
- •Плоскости симметрии на примере комплексного иона [CuF4]─.
- •1. Правило соответствия
- •2. Правило ассоциативности группового умножения
- •Квантово-химическое описание реакций Квантовая теория химических реакций Понятие о поверхностях потенциальной энергии.
- •Симметрия и относительная энергия мо бутадиена (а) и этилена (б).
- •Схемы строения переходных комплексов для реакции димеризации этилена и взаимодействия этилена с бутадиеном.
- •Симметрия переходного состояния реакции взаимодействия этилена с бутадиеном
II. Способность атома поглощать и испускать излучение подчиняется закону, по которому излучение, связанное с переходом, должно быть монохроматическим и иметь частоту ν, определяемую соотношением
Е1 – Е2 = hν |
|
где h – постоянная Планка и Е1 и Е2 – энергия двух соответствующих стационарных состояний.
Д. Франк и Г. Герц (1913 – 1914 гг.).
При неупругих столкновениях электрона с атомом происходит передача энергии от электрона атому.
Если внутренняя энергия атома изменяется непрерывно, то атому может быть передана любая порция энергии. Если же состояния атома дискретны, то при неупругом столкновении электрон может передать атому лишь определенные порции энергии.

Схема опыта Франка и Герца

Зависимость силы анодного тока в цепи от ускоряющей разности потенциалов eVа.
Разница внутренних энергий основного состояния атома ртути и ближайшего возбужденного состояния eV равна 4,9 эВ, что доказывает дискретность внутренней энергии атома и, следовательно, справедливость первого постулата Бора.
Строение атома водорода по H. Бору и объяснение важнейших закономерностей атомных спектров.
ν = Tn – Tk
hv = Eк – En
En= -hTn,; Ek = – hTk.
p = nh/2π = mvr |
|
n – положительное целое число, названное главным квантовым числом; h – постоянная Планка; m и v – масса и скорость электрона; r – радиус орбиты.
|
|
где Z – порядковый номер элемента, r – радиус орбиты электрона.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
||
|
|
||
|
|
||
|
|
|
|
|
|

Схема энергетических уровней атома водорода. Цифры у вертикальных линий, обозначающих переходы, – длины волн в нм.
Развитие теории строения атома Бора.

Параметры r и φ для электрона, вращающегося по окружности и эллиптической орбите.
![]()
n = l + nr |
|
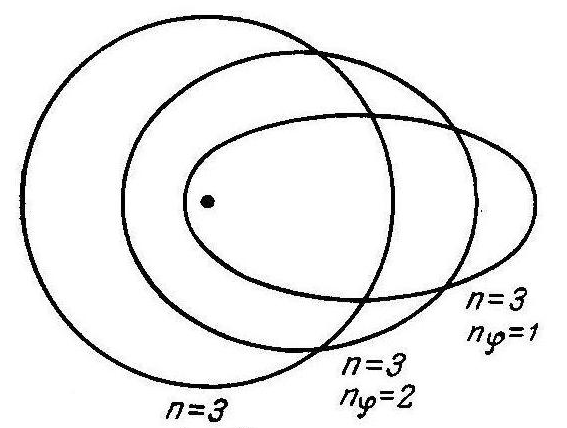
Возможные электронные орбиты при квантовом числе n = 3.

Эффект Зеемана для двух близких спектральных линий атома натрия (жёлтого дублета Na) в магнитном поле при наблюдении поперёк и вдоль поля.
pz = mlh |
|
Контрольные вопросы и задания.
Каким образом получают атомные спектры испускания?
Какое значение имеет атомная спектроскопия для химии?
Какие спектральные серии наблюдаются в атомном спектре водорода, в какой последовательности они были открыты?
Энергия какого перехода в атоме Н больше – с n = 14 на n = 15 или с n = 114 на n = 115? Почему?
Серия Хемфри является одной из серий в спектре атомарного водорода. Она начинается при 12368 нм и может быть прослежена до 3281,4 нм. Какие переходы дают ее? Каковы длины волн промежуточных переходов?
В чем сущность экспериментов Д. Франка и Г. Герца, что они доказывают?
Каким образом теория строения атома Бора объясняла основные закономерности атомных спектров?
Чем модель атома А. Зоммерфельда отличается от модели Бора?
Каковы принципиальные затруднения теории строения атома Бора?
Корпускулярно-волновая природа вещества
Л. де Бройль (1924 г.) - двойственной природой обладает любой движущийся материальный объект.
|
(4.1.) |
λ – длина волны; т – масса; v – скорость, Eк – кинетическая энергия.
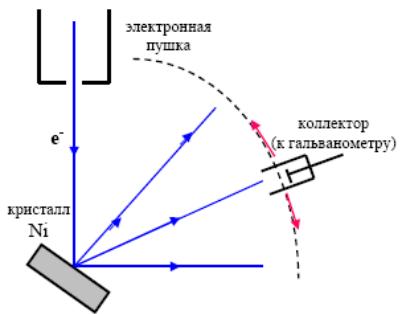
Схема опыта К. Дэвиссона и Л. Джермера

Зависимость
силы тока i
в цепи
от
![]()
nλ = 2d sinθ |
(4.2.) |
|
(4.3.) |
|
|
(4.4.) |
|
|
(4.5.) |
|
где
|
(4.6.) |
Опыт Томсона и Тартаковского
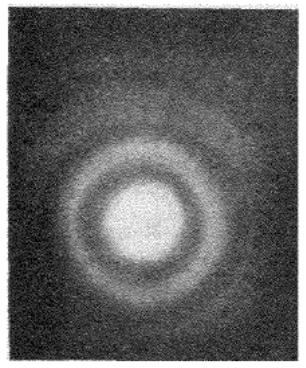
Дифракционная картина, возникающая при рассеянии электронов в пленке золота
Принцип неопределенностей Хайзенберга
|
(4.7.) |
|
(4.8.) |
ОСНОВЫ КВАНТОВО – МЕХАНИЧЕСКОЙ ТЕОРИИ
Волна – это изменение состояния среды (возмущение), распространяющееся в этой среде и переносящее с собой энергию.

Бегущие волны.
|
(5.1.) |
|
(5.2.) |
φ – амплитуда смещения расстоянии х от начала струны; λ – длина волны; ν — частота; а – постоянная (максимальное значение амплитуды); с – скорость распространения волны
a1φ1 + a2φ2
|
(5.3.) |
где λ = c/v
а |
б |
Недопустимые решения волнового уравнения для одномерных колебаний натянутой струны. |
|




 ,
,