- •Л.С.Сухорукова, т.І.Курова, н.І.Мальцева, в.І.Григор’єва,
- •Основи загальної хімії Навчальний посібник
- •Атомно-молекулярне вчення
- •Основні закономірності перебігу хімічних реакцій
- •Розчини. Дисперсні системи
- •Молярна концентрація еквівалента або нормальність (сн) визначається
- •Основи дисоціюють з утворенням катіонів металу і гідроксид-іонів он-:
- •Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
- •Властивості деяких кислотно-основних індикаторів
- •Ступінь гідролізу визначається співвідношенням:
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
- •Зміна механічних властивостей гелю кремнієвої кислоти h2SiO3 при обезводненні
- •Будова речовини
- •Головна підгрупа Побічна група
- •Двох періодів
- •Відносні електронегативності елементів(за шкалою Полінга)
- •2 Відштовхування rзв. Е, кДж/моль
- •Окисно-відновні реакції. Основи електрохімії
- •5.3. Корозія металів. Методи захисту металів від корозії
- •1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
- •Неметали
- •Неорганічні в'яжучі речовини
- •Приблизний мінералогічний склад портландцементного клінкеру
- •Характеристики процесів гідратації та продуктів твердіння складових портландцементу
- •Органічні сполуки
- •Найважливіші класи органічних сполук
- •Органічні полімерні матеріали в будівництві
- •Xімія та екологія
Найважливіші класи органічних сполук
Клас сполук |
Функціональні групи |
|||
Назва |
Загальна формула |
Приклад сполук |
Назва |
Формули |
Вуглеводні |
або
|
CH4, C2H6, C2H2, C6H6 |
—
|
— |
Галогенопохідні вуглеводнів |
R-наl |
|
Галогени |
|
Спирти феноли |
|
|
Гідроксиль-на(гідроксил) |
|
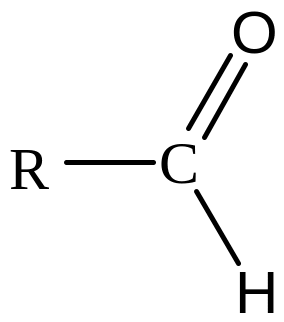
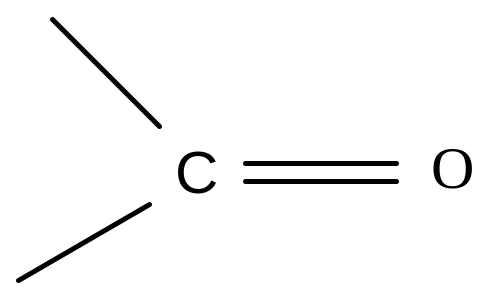
Альдегіди |
|
|
Альдегідна |
|
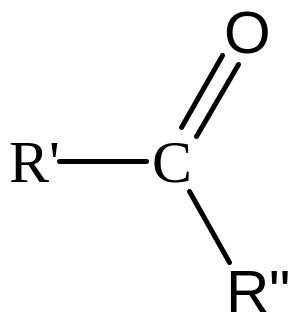
Кетони |
|
|
Карбонільна (карбоніл) |
|
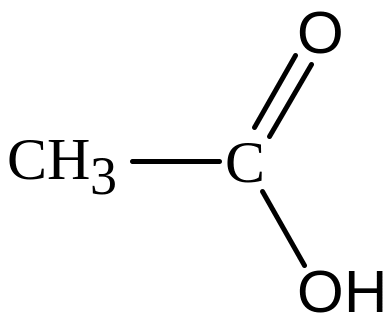
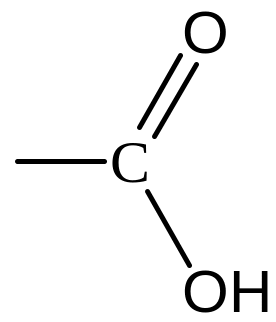
Карбонові кислоти |
|
|
Карбоксильна (карбоксил) |
|
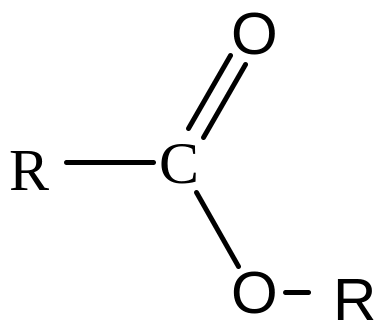
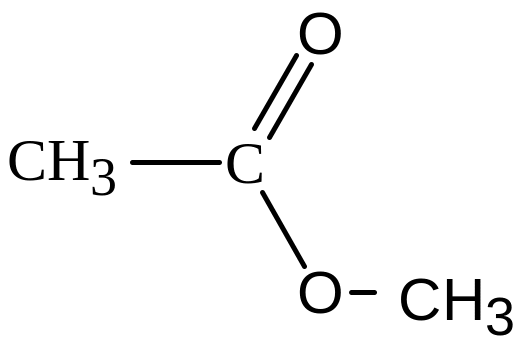
Складні ефіри |
|
|
Складноефірна |
|
Нітросполуки |
|
|
Нітрогрупа |
-NO2 |
Аміни (первинні) |
|
|
Аміногрупа |
-NН2 |
Сульфокислоти |
|
|
Cульфогрупа |
-SO3H |
Кожний клас сполук утворює гомологічні ряди. Гомологічний ряд — це ряд сполук, у якому кожний наступний представник відрізняється від поперед-нього на групу атомів — СН2, яка називається гомологічною різницею. Гомо-логічний ряд кожного класу зображується загальною формулою. Наприклад, насичені вуглеводні мають загальну формулу CnH2n+2.
СН4 - метан; С6Н14 - гексан;
С2Н6 - етан; С7Н16 - гептан;
С3Н8 - пропан; С8Н18 - октан;
С4Н10 - бутан; С9Н20 - нонан;
С5Н12 - пентан; С10Н22 - декан.
Ізомерія. Усі класи органічних сполук утворюють ізомери. Розрізняють структурну і просторову ізомерію. Структурна ізомерія може бути обумовлена:
а) різним порядком сполучення атомів вуглецю (ізомерія вуглецевого скелету)
СН3–СН2–СН2–СН3 СН3–СН–СН3;
бутан
СН3
ізобутан
б) різним положенням кратного зв’язку або функціональної групи (ізоме-рія положення)
СН3–СН2-СН=СН2 СН3-СН=СН-СН3;
бутен-1 бутен-2
в) належністю сполук до різних класів (міжгрупова ізомерія)
СН2=СН–СН2–СН3 Н2С–СН2
бутен-1 | |
Н2С – СН2.
циклобутан
Просторова ізомерія обумовлена неоднаковим просторовим положенням різних замісників відносно подвійного зв’язку (геометрична або цис-транс-ізомерія). Вона характерна для сполук з подвійним зв’язком. Якщо одинакові замісники знаходяться по один бік подвійного зв’язку — це цис-ізомер, якщо по різні — це транс-ізомер.
9.4. НОМЕНКЛАТУРА
Органічні сполуки називають за тривіальною (історичною), раціональною і систематичною (міжнародною або ІЮПАК) номенклатурами.
В основу тривіальної номенклатури покладено назву джерела, з якого вперше була виділена дана сполука або випадкова назва. Наприклад, мурашина, яблучна, молочна кислоти, винний спирт. Ця номенклатура не дає можливості називати ізомери.
В основу раціональної номенклатури покладено назву першого члена го-мологічного ряду даного класу сполук. Наприклад:
СН4 СН3–СН2–СН3.
метан диметилметан
За систематичною номенклатурою сполуки називають як похідні наси-чених вуглеводнів з відповідною зміною закінчення, що відповідає назві функ-ціональної групи. Назви ациклічних насичених вуглеводнів мають закінчення ан (пропан); ненасичених вуглеводнів з одним подвійним зв’язком — ен (пропен); ненасичених вуглеводнів з двома подвійними зв’язками — дієн (бута-дієн); з потрійним зв’язком — ін (пропін); спиртів — ол (пропанол); альдегідів — аль (пропаналь); кетонів — он (пропанон); кислот — ова кислота (пропа-нова кислота).
СН3–СН2–СН2 –СН3 - бутан
СН2=СН–СН2–СН3 - бутен-1
СН2=СН–СН=СН2 - бутадієн-1,3
СН3–СН2–СН2–СН2–ОН - бутанол-1
О
СН3–СН2–СН2–С - бутаналь
Н
О
СН3–СН2–СН2–С - бутанова кислота
ОН
СН3–С–СН2–СН3 - бутанон-2
О
Назви ізомерних сполук утворюються таким чином:
а) вибирають найдовший нерозгалужений вуглецевий ланцюг (головний), що містить найбільше число функціональних груп або кратний зв’язок, харак-терний для даного гомологічного ряду;
б) атоми вуглецю в головному ланцюзі нумерують, починаючи з того кінця, до якого ближче функціональна група, кратний зв’язок або замісник (вуглеводневі радикали і функціональні групи, які знаходяться в бічному ланцюзі розглядаються як замісники атомів водню головного ланцюга);
в) положення замісника в бічному ланцюзі позначають номером вуглецевого атома, біля якого знаходиться замісник, потім називають цей замісник, а в кінці називають насичений вуглеводень, що відповідає головному ланцюгу, і змінюють або додають закінчення залежно від наявності кратного зв’язку і функціональної групи головного ланцюга місце положення яких позначають цифрою після кореня слова - назви. Якщо замісників декілька, цифрами позначають кожний із них і розташовують їхні назви в алфавітному порядку.
Наприклад: 1 2 3 4 5 6 7
H2C=C–CH2–CH–CH2–CH2–CH3
CH2 CH3 2-етил-4-метил-гептен-1
CH3
Якщо в головному ланцюзі міститься декілька однакових замісників, то їх загальна кількість позначається грецьким числівником (ди-, три-, тетра- тощо), який ставлять перед назвою цих радикалів, а їхнє положення вказують цифрою. Наприклад:
СН3
1 2 3 4 5 6 7
СН3–СН2–С – СН– СН2–СН2–СН3 3,3,4-триметилгептан
СН3 СН3
Розділ 10