
- •Л.С.Сухорукова, т.І.Курова, н.І.Мальцева, в.І.Григор’єва,
- •Основи загальної хімії Навчальний посібник
- •Атомно-молекулярне вчення
- •Основні закономірності перебігу хімічних реакцій
- •Розчини. Дисперсні системи
- •Молярна концентрація еквівалента або нормальність (сн) визначається
- •Основи дисоціюють з утворенням катіонів металу і гідроксид-іонів он-:
- •Наприклад, дисоціацію такого індикатора як лакмус, можна описати рівнянням
- •Властивості деяких кислотно-основних індикаторів
- •Ступінь гідролізу визначається співвідношенням:
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища
- •Зміна механічних властивостей гелю кремнієвої кислоти h2SiO3 при обезводненні
- •Будова речовини
- •Головна підгрупа Побічна група
- •Двох періодів
- •Відносні електронегативності елементів(за шкалою Полінга)
- •2 Відштовхування rзв. Е, кДж/моль
- •Окисно-відновні реакції. Основи електрохімії
- •5.3. Корозія металів. Методи захисту металів від корозії
- •1. Якщо в розчині присутні аніони безкисневих кислот s2-,I-,Br-,Cl- (крім f-) або іони , то відбувається окиснення цих аніонів у послідовності:
- •Неметали
- •Неорганічні в'яжучі речовини
- •Приблизний мінералогічний склад портландцементного клінкеру
- •Характеристики процесів гідратації та продуктів твердіння складових портландцементу
- •Органічні сполуки
- •Найважливіші класи органічних сполук
- •Органічні полімерні матеріали в будівництві
- •Xімія та екологія
Органічні сполуки
9.1. ЗАГАЛЬНА ХАРАКТЕРИСТИКА
До органічних речовин належать усі сполуки вуглецю, за винятком СО, СО2, Н2СО3, солей вугільної кислоти, карбідів, цианідів та деяких інших речо-вин, що мають більше спільних властивостей з неорганічними, ніж з органіч-ними речовинами.
Органічні сполуки обов’язково містять атоми вуглецю і водню, крім того до складу їхніх молекул можуть також входити кисень, азот, сірка, фосфор, галогени. Тому органічні сполуки можна визначити як вуглеводні та їхні похідні.
Завдяки унікальній здатності атомів вуглецю утворювати хімічні зв’язки один з одним та з атомами більшості інших елементів, кількість органічних сполук надзвичайно велика, більша, ніж неорганічних, утворених усіма елементами періодичної системи.
Органічні сполуки мають ряд характерних особливостей, які стали причи-ною виділення органічної хімії в самостійну науку, як хімію сполук вуглецю.
1. В молекулах органічних сполук атоми з’єднані в основному ковалентними зв’язками, неполярними (С–С) або мало полярними (С–Н), тому більшість органічних сполук не є електролітами.
2. Хімічні реакції між органічними сполуками відбуваються повільніше, ніж між неорганічними і, як правило, не доходять до кінця.
3. Органічні сполуки не такі стійкі, як неорганічні, легко змінюються під час нагрівання, більшість з них горючі.
4. Молекули багатьох органічних сролук складаються з великої кількості атомів, що не характерно для неорганічних сполук.
Для органічних речовин характерне явище ізомерії, тобто існування речо-вин з однаковим якісним і кількісним складом і молекулярною масою але різною будовою, і тому з різними фізичними та хімічними властивостями.
9.2. ТЕОРІЯ ХІМІЧНОЇ БУДОВИ ОРГАНІЧНИХ СПОЛУК
О. М. БУТЛЕРОВА
Науковим фундаментом сучасної теорії будови хімічних сполук стала структурна теорія (або теорія будови органічних сполук), яка була розроблена в другій половині XIX століття і в яку величезний внесок зробила наукова школа російського хіміка О. М. Бутлерова.
Суть цієї теорії зводиться до таких основних положень:
1. Атоми розташовані в молекулах не безладно, а сполучені один із одним хімічними зв’язками в певній послідовності відповідно до їхніх валентностей. Ця послідовність називається хімічною будовою. Хімічну будову можна зобра-зити структурною формулою, в якій хімічні зв’язки між атомами зображуються рисками.
2. Властивості речовин залежать не тільки від їхнього якісного та кількісного складу, але й від хімічної будови молекул.
Це означає, що ізомери (речовини з однаковим складом, але різною будо-вою) мають різні властивості. Наприклад, етанол та диметиловий ефір.
СН3–СН2–ОН СН3–О–СН3
етанол диметиловий ефір
3. За властивостями даної речовини можна визначити будову її молекули, а за будовою молекули передбачити її властивості.
4. Атоми або групи атомів у молекулах взаємно впливають один на одного, безпосередньо або через інші атоми. Так, у молекулі оцтової кислоти СН3СООН атом водню в групі СООН може відщеплюватися в водному розчині в вигляді іону Н+, а атом водню в групі СН3 міцно зв’язаний з атомом вуглецю і не може відщеплюватися у вигляді іона.
Квантово-механічні уявлення про будову атомів і молекул блискуче під-твердили і поглибили основні положення цієї теорії.
Вуглець в усіх органічних сполуках чотиривалентний. Відповідно до сучас-них електронних уявлень хімічний зв’язок виникає за рахунок неспарених елек-тронів атома. Атом вуглецю при утворенні органічної сполуки переходить у збуджений стан:
С(1s22s22p2) → C*(1s22s12p3).
Чотири орбіталі атома вуглецю, що мають неспарені електрони, дають мо-жливість атому утворити чотири ковалентні зв’язки, тобто бути чотиривалент-ним в сполуках. Усі чотири зв’язки, які утворює вуглець, абсолютно рівноцін-ні. Це пояснюється тим, що в момент утворення зв’язків відбувається гібриди-зація (змішування та вирівнювання орбіталей за формою і енергією) атомних s- і р- орбіталей з утворенням чотирьох однакових гібридних орбіталей.
Для атома вуглецю можливі три валентних стани з різними типами гібри-дизації: sp3 - , sp2-, sp - гібридизація.
Атоми вуглецю здатні з’єднуватися один із одним одинарним зв’язком
(–С–С–; sp3- гібридизація, валентні кути 109°28´); подвійним (–С=С–; sp2 - гібридизація, валентні кути 120°) і потрійним зв’язком (–С≡С–; sp- гібриди-зація, валентний кут 180º), утворюючи прямі, розгалужені і замкнуті ланцюги.
9.3. КЛАСИФІКАЦІЯ
Залежно від будови вуглецевого ланцюга органічні сполуки поділяють на ациклічні й циклічні.
Ациклічними є сполуки, молекули яких складаються з відкритих (незамкне-них) вуглецевих ланцюгів — прямих або розгалужених:
— С —
— С — С — С — С —
— С — С — С —
прямий ланцюг розгалужений ланцюг
Ациклічні сполуки називають аліфатичними або сполуками жирного ряду. Їх поділяють на насичені та ненасичені. Сполуки з простими (одинарними) - зв’язками (С–С) є насиченими, а з кратними +π - зв’язками (С=С, СС) — ненасиченими.
Циклічними називають сполуки, молекули яких складаються з замкнених у кільця вуглецевих ланцюгів. Циклічні сполуки поділяють на карбоциклічні (цикли містять тільки атоми вуглецю) і гетероциклічні (цикли містять, крім атомів вуглецю, атоми інших елементів — кисню, азоту, сірки тощо:).
СН2
НС
СН
НС
СН
СН
N
CH2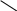
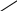

Н2С
СН2
Н2С
СН2 + СН2
карбоциклічна сполука гетероциклічна сполука
Ациклічні й циклічні сполуки поділяють на класи за функціональними групами. Функціональними називають групи атомів, що надають речовинам певних хімічних властивостей. Вихідним класом при такій класифікації є спо-луки вуглецю з воднем — вуглеводні. Шляхом заміщення водневого атому в вуглеводнях на функціональну групу можна перейти до будь-якого класу сполук.
Будь-який клас органічних сполук можна зобразити загальною формулою R-Х, де Х — функціональна група, R — радикал (залишок вуглеводня, який утворюється, якщо від молекули відняти один атом водню).
Наприклад: СН4-метан; СН3-радикал «метил»;
С2Н6-етан; С2Н5-радикал «етил».
Найважливіші класи органічних сполук наведені в таблиці 7.
Таблиця 7
