
- •Конова л.Б., Любин н.А., Шленкина т.М., Васина с.Б. Патологическая физиология
- •Ульяновск, 2006
- •Введение
- •Раздел 1. Общее учение о болезни
- •Тема 1. Предмет и задачи патологической физиологии
- •Тема 2. Общая нозология
- •Тема 3. Общая этиология
- •Тема 4. Общий патогенез
- •Тема 5. Действие болезнетворных факторов на животный организм
- •Тема 6. Патологическая физиология клетки (для самостоятельного изучения)
- •Тема 7. Реактивность, резистентность, иммунитет
- •Раздел 2. Типовые патологические процессы
- •Тема 8. Патологическая физиология периферического кровообращения и микроциркуляциии
- •Р ис. 16. Эмболия сосудов малого и большого кругов кровообращения:
- •Тема 9. Воспалительный процесс
- •Вопросы для контроля знаний:
- •Тема 10. Лихорадка
- •Тема 11. Патологическая физиология типовых нарушений обмена веществ
- •Раздел 3. Патологическая физиология органов и систем животного организма
- •Тема 12. Патологическая физиология крови
- •Тема 13. Патологическая физиология системы кровообращения
- •Темы рефератов
- •Тема 14. Патологическая физиология иммунной системы (для самостоятельного изучения)
- •Тема 15. Патологическая физиология дыхания
- •Тема 16. Патологическая физиология пищеварения
- •Тема 17. Патологическая физиология печени
- •Тема 18. Патологическая физиология почек (для самостоятельного изучения)
- •Тема 19. Патологическая физиология эндокринной системы
- •Тема 20. Патологическая физиология нервной системы
- •Использованная литература:
- •Содержание
- •Патологическая физиология
Тема 11. Патологическая физиология типовых нарушений обмена веществ
Постоянство концентрации водородных ионов (рН) во внутренней среде — необходимое условие для нормального функционирования жизненно важных процессов животного организма. Это постоянство зависит от соотношения между кислотами и основаниями в крови и в тканях. Кислотно-основное равновесие, поддерживаемое высшими животными в пределах рН 7,3-7,6, – жесткая константа, обеспечиваемая буферными системами биологических сред. Снижение уровня рН плазмы крови ниже 6,8 или смещение водородного показателя на величину более чем 7,8 становятся несовместимыми с жизнью. Изменения кислотно-основного равновесия встречаются при многих заболеваниях и приводят либо к накоплению в биологических средах кислот с повышением концентрации водородных ионов – ацидозу, либо к понижению концентрации водородных ионов – алкалозу, относительному или абсолютному накоплению оснований.
Нарушение кислотно-основного равновесия может возникать в такой форме, когда рН остается в пределах нормальных, свойственных здоровому животному величин (рН крови лошади 7,3-7,5; свиньи 7,44-7,47; крупного рогатого скота 7,3-7,45) за счет снижения резервных возможностей организма, его буферных систем: бикарбонатного, фосфатного, белкового буферов, окисленного или восстановленного гемоглобина. Избыточно образовавшиеся кислые или основные (щелочные) продукты метаболизма подвергаются нейтрализации и выведению из организма. Ацидоз или алкалоз в этих случаях носит название компенсированного.
Обострение или хронизация патологии приводит к недостаточности буферных систем, регуляторные механизмы не могут удерживать водородный показатель (рН) в физиологических границах. Развивается некомпенсированный ацидоз или некомпенсированный алкалоз.
Занятие 18. Нарушение кислотно-основного равновесия
Цель занятий. Изучить этиологию, патогенез и проявления нарушений кислотно-основного равновесия у животных с патологией обмена веществ в эксперименте.
Задание 1. Изучить механизмы нарушений кислотно-основного равновесия. Изменение резервной щелочности крови собаки, у которой удалена поджелудочная железа.
Оснащение: сдвоенные колбы по И. П. Кондрахину, подготовленные к титрованию; микробюретка на 2 мл (15); 0,02 н. раствора серной кислоты (0,01 моль/л) (50 мл); 1%-ный раствор фенолфталеина (10 мл).
Постановка опыта. За день до занятия в хозяйстве или стационаре клиники получают кровь от больных животных и подготавливают ее к исследованию диффузионным методом с помощью сдвоенных колб по И. П. Кондрахину.
В чистую, сухую центрифужную пробирку помещают 1 мл вазелинового масла и 20 ЕД гепарина на 1 мл крови, 2-5 мл крови, взятой из яремной вены, вносят в подготовленную пробирку, закрывают ее пробкой и кровь осторожно перемешивают с антикоагулянтом. От каждого животного кровь берут в отдельную пробирку, на которой ставят номер. Пробирки доставляют в лабораторию, где их центрифугируют в течение 20 мин при 3000 об./мин и помещают в холодильник при температуре 4°С. По количеству проб крови с учетом параллельных исследований подготавливают сдвоенные колбы. Для контроля оставляют не менее трех сдвоенных колб. Все колбы закрывают резиновыми пробками и открывают только в момент внесения реактива, после чего сразу опять закрывают. Точность результатов всей серии исследований зависит от точности титрования гидроокиси натрия в контрольных колбах.
На левых колбах всех пар ставят номера, соответствующие номерам проб крови на пробирках, или букву «К» на контрольных колбах. В правые колбы всех пар из бюретки вливают по 2 мл 0,02 н. (0,02 моль/л) раствора натрия гидроксида, в смежные (левые) колбы (кроме контрольных) вносят пипетками (не выдувая) по 0,5 мл плазмы крови, находящейся под вазелиновым маслом. Во всех случаях, когда реактивы вводят в колбы пипетками, их не выдувают, а дают свободно стекать. Затем во все левые колбы из бюретки или пипеткой поочередно вносят по 1 мл 5%-ного раствора серной кислоты (0,5 ммоль) и быстро плотно закрывают колбы пробками. Вращательными движениями перемешивают плазму крови с кислотой (не менее трех раз). Колбы оставляют на ночь. На следующий день приступают к титрованию.
Каждый студент получает 3-4 сдвоенные колбы, подготовленные для титрования в предыдущий день. Титруют содержимое правых колб, а обозначения (К – контроль, № животного) пишут на левых колбах. Все колбы должны быть плотно закрыты, их открывают только в момент внесения реактивов.
Поочередно титруют содержимое колб. Для этого открывают правую колбу с раствором натрия гидроксида и вносят в нее 1-2 капли раствора фенолфталеина, затем из микробюретки на 2 мл, заполненной 0,01 моль/л (0,02 н.) раствором серной кислоты, титруют до полного обесцвечивания раствора. Скорость титрования контрольных и опытных проб должна быть одинаковой. Результаты титрования записывают в таблицу и рассчитывают резервную щелочность (X) в объемных процентах СОз на 100 мл плазмы крови по формуле
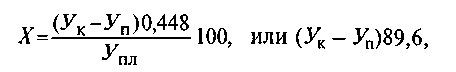
где Ук – количество 0,01 моль/л раствора серной кислоты, пошедшее на титрование контроля, мл; Уп – количество 0,01 моль/л раствора серной кислоты, пошедшее на титрование исследуемого образца, мл; Упл – количество плазмы крови (в методике принято равным 0,5), мл; 0,448 – коэффициент данной реакции; 100 – коэффициент для пересчета результатов анализа на 100 мл плазмы крови.
Оформление протокола опыта. В протоколе кратко излагают постановку опыта и записывают показатели щелочного резерва крови у интактной и депанкреатизированной собак. Делают выводы. Объясняют механизм нарушения и компенсации кислотно-основного равновесия у собаки с удаленной поджелудочной железой.
В норме щелочной резерв у крупного рогатого скота — 46-66, у овец — 48—60 об.% СО2. Делают выводы. Объясняют механизм нарушения кислотно-основного равновесия. Называют вид нарушения.
Нормальные показатели щелочного резерва крови составляют: у собак 40-60 об.% СО2, у овец 50-52, у крупного рогатого скота 46- 54 об.%СО2.
Задание 2. Гипогликемическая кома у мыши.
В организме животных углеводы участвуют в разнообразных метаболических реакциях, взаимодействуя с белками и липидами. Одна из главных функций углеводов состоит в том, что они представляют собой основной энергетический субстрат для клеток всех тканей, но особенно нервной. Установлено, что 67 % глюкозы крови потребляют клетки центральной нервной системы.
Углеводы поступают в организм с растительной и животной пищей в виде моно-, ди- и полисахаридов. Может быть избыточное, а чаще недостаточное снабжение животных углеводами. Последнее обстоятельство сразу сказывается на межуточном обмене веществ, так как для энергетических целей начинают использоваться жиры и в какой-то степени белки.
Недостаточная обеспеченность организма углеводами возможна в результате нарушения процессов переваривания и всасывания. Например, при недостаточном поступлении гликолитических ферментов поджелудочной железы и кишечного сока (амилаза, лактаза). Полное расщепление углеводов до сахаров в тонком кишечнике не всегда завершается всасыванием. Уровень углеводов в крови поддерживается нейрогуморальными механизмами.
Уровень глюкозы в крови здоровых взрослых животных колеблется (мг/100 мл): крупный рогатый скот — 40-60, лошади — 55-95, свиньи — 45-75, собаки — 60-80, куры — 80-140, кролики — 75-85.
У больных животных эти показатели могут существенно меняться за счет интенсивности поступления углеводов, синтеза гликогена, уровня потребления глюкозы, соотношения этих процессов.
Под гипогликемией понимают уменьшение содержания глюкозы в крови. Основные ее причины:
недостаточное поступление углеводов с кормами; снижение гидролиза сахаров в кишечнике и замедление их всасывания; повышение тонуса парасимпатической иннервации; недостаточная выработка глюкокортикоидов, соматотропного и адренокортикотропного гормонов передней доли гипофиза; повышение секреции инсулина, обусловленное гиперплазией островкового аппарата поджелудочной железы, развитием (у собак) раковой опухоли; развитие гепатопатий (гепатит, острая жировая дистрофия, цирроз) с подавлением гликогенообразовательной функции;
гипофизарная кахексия; интенсивная мышечная работа, особенно у лошадей при длительных переходах, перевозке грузов; передозировка инсулина, вводимого животным с лечебной целью.
Последствия гипогликемии обусловлены, прежде всего, изменениями деятельности центральной нервной системы. Глюкоза для ее клеток является основным энергетическим субстратом. Недостаток сахара приводит к истощению энергетических резервов, усилению катаболических процессов, гипоксии структур мозга, внутриклеточной гипергидратации. Повышение проницаемости стенок сосудов сопровождается отеком мозга, возможностью кровоизлияний и тромбоза.
У жвачных животных возможно развитие гипогликемического синдрома, проявляющегося первоначально астеническим состоянием, затрудненностью передвижения. В последующем наблюдается беспокойство, появляются дрожь, клонические и тонические судороги, обильная саливация, непроизвольные дефекация и мочеиспускание. Одышка, тахикардия, зрачки расширены. Возможно развитие коматозного состояния.
Оснащение: шприцы на 1 мл с иглами; инсулин (1 флакон); 10%-ный раствор глюкозы (10 мл); подопытные животные: мыши.
Постановка опыта. Гипогликемическую кому воспроизводят с помощью инсулина. Мышей перед опытом выдерживают сутки без корма. Дачу воды не ограничивают.
Подопытным мышам вводят инсулин под кожу по 0,25 ЕД на животное. Другой группе мышей одновременно с инсулином в брюшную полость вводят по 1 мл 10%-ного раствора (0,55 моль/л) глюкозы. Наблюдают за поведением животного.
Оформление протокола опыта. Кратко записывают условия опыта и подробно излагают изменения в поведении мышей. Сравнивают поведение мышей, которым вводили только инсулин, с поведением животных, которым кроме инсулина инъецировали также глюкозу. Делают выводы. Объясняют профилактическое действие глюкозы.
Занятие 19. Нарушения водного и электролитного обменов
Цель занятий: Изучить этиологию, патогенез и проявления нарушений углеводного, водного и электролитного обменов
Вода имеет исключительно важное значение в жизнедеятельности организма. Она входит в структуру всех клеточных элементов, представляет собой среду, где протекают обменные процессы. Обмен воды самым тесным образом связан с минеральным обменом. Большинство минеральных соединений находится в растворенном состоянии. Их перемещение в организме невозможно без участия воды. Соли, в свою очередь, обладая способностью связывать воду, во многом определяют ее содержание в биологических объектах. Водно-электролитный баланс является одним из определяющих факторов в поддержании постоянства внутренней среды организма — гомеостаза.
На долю воды в организме взрослых сельскохозяйственных животных приходится 55-65 % массы тела. У новорожденных она достигает 70-80 %, а к старости значительно (до 45 %) снижается. Вода поступает в организм с питьем и кормом. Она образуется и эндогенно, как результат окисления белков, углеводов и жиров. Окисление 100 г белков сопровождается выделением 41 мл воды, 100 г углеводов – 55, 100 г жира – 107 мл воды.
Содержащуюся в организме воду подразделяют на внутриклеточную (интрацеллюлярную) и внеклеточную (экстрацеллюлярную). Внутриклеточная жидкость находится в трех состояниях: вода, химически и физически связанная с гидрофильными структурами протоплазмы; вода, находящаяся на поверхности коллоидных структур; вода, находящаяся в лакунах протоплазмы, химически не связанная. Всего на долю интрацеллюлярной воды приходится около 72 % ее общего содержания в организме.
Внеклеточная вода составляет около 28 %. Она включает воду плазмы циркулирующей крови, интерстициальной и трансцеллюлярной жидкостей.
В составе плазмы крови на долю воды в среднем приходится 91 %. Важнейшая функция плазмы крови — поддержание гомеостаза, в чем значительная роль принадлежит минеральным солям. Плазма крови содержит электрически заряженные ионы. Катионами являются Na , К+, Mg2 , Са2+, анионы представлены Сl-, НСО3, НРО4, Н2РО4, органическими кислотами, белками. Электролиты, частично глюкоза и мочевина обеспечивают осмотическое давление и перемещение жидкости крови к тканям.
Водно-электролитный баланс регулируется нейроэндокринной системой, обеспечивающей устойчивое постоянство.
Отек (греч. oidema) — избыточное скопление жидкости в тканях вследствие нарушения обмена воды между кровью и межклеточной жидкостью. Отек подкожной клетчатки — анасарка (anasarca).
Отек относят к типичным патологическим процессам, наблюдаемым при многих заболеваниях животных.
Отек относят к типичным патологическим процессам, наблюдаемым при многих заболеваниях животных.
Развитие отека обусловлено многими факторами, но из них следует выделить ведущие, среди которых изменение гидродинамического, осмотического и онкотического давлений. В обычных физиологических условиях гидродинамическое давление в артериальной части капилляра равно 35-40 мм рт. ст., оно выше онкотического (25 мм рт. ст.). Выталкивающая сила больше удерживающей, и плазма крови через гистогематический барьер направляется в ткани. В венозной части капилляра онкотическое давление остается прежним (25 мм рт. ст.), а гидродинамическое снижено до 10-15 мм рт. ст., поэтому жидкость из межтканевых щелей направляется в кровеносные сосуды — венозную часть капилляра.
В зависимости от причин и механизма развития выделяют такие виды отеков, как сердечные (застойные), почечные, кахексические, токсические, эндокринные, нейрогенные, воспалительные, аллергические.
Токсические отеки. Чаще всего наблюдаются у животных после укусов ядовитых змей, пчел, других жалящих насекомых. Причинами таких отеков могут быть также отравления боевыми отравляющими веществами (фосген, дифосген), хлором, аммиаком. Вдыхание газообразных токсигенов приводит к отеку легких, а поражение кожи ипритом, люизитом, кротоновым маслом, другими токсическими веществами ведет к ее отеку. Некоторые инфекционные заболевания (сибирская язва и др.), характеризующиеся интоксикацией, также сопровождаются отеками тканей.
В генезе токсических отеков основное значение отводят повышению проницаемости сосудистой стенки, гиперонкии в связи с альтерацией клеток и гиперосмии. Транссудации способствуют освобождаемые поврежденными клеточными элементами вазоактивные вещества типа гистамина, серотонина, брадиюшина, простагландинов. Возможно рефлекторное влияние на вазомоторы, сопровождающееся дилатацией капиллярной сети, повышением проницаемости сосудов. Токсические отеки локальны, их границы определены действием этиологического фактора.
Задание 1. Токсический отек легких у крысы.
Оснащение: шприцы на 2 мл с иглами; 6%-ный раствор аммония хлорида (10 мл); изотонический раствор натрия хлорида (10 мл); подопытные животные: крысы.
Постановка опыта. Подбирают двух одинаковых или близких по массе тела крыс. Записывают в протокол массу тела, исходное состояние и поведение животных. После этого подопытной крысе под кожу или в брюшную полость вводят аммония хлорид из расчета 0,7мл 6%-ного раствора на 100 г массы тела (8 ммоль/кг). Контрольной крысе таким же способом и в таком же объеме вводят изотонический раствор натрия хлорида. Отмечают постепенное нарушение ритма и частоты дыхания. Наблюдения ведут в течение 40-50 мин. Если за это время подопытная крыса не погибнет, то обеих крыс умерщвляют электрическим током. Если одна из них погибает раньше чем за 40 мин, одновременно умерщвляют другую крысу.
У крыс вскрывают грудную клетку, отпрепаровывают легкие, накладывают лигатуру на их корень и экстирпируют. Затем осматривают легкие, определяют макроскопические изменения. После этого легкие подопытной и контрольной крыс отдельно взвешивают и вычисляют коэффициент отношения массы легких к массе тела животного в процентах (легочно-соматический коэффициент).
Оформление протокола опыта. Отмечают состояние и поведение крыс до опыта и в динамике после опыта, который хронометрируют. Особое внимание обращают на ритм и амплитуду дыхания. При вскрытии описывают картину и посмертно определяют легочно-соматический коэффициент. Делают выводы. Объясняют механизм развития отека.
Задание 2. Развитие отека в зависимости от гидрофильности тканей.
Оснащение: стеклянные банки на 500 мл; лигатура (толстый шелк); подопытные животные: лягушки.
Постановка опыта (опыт Фишера). У лягушки туго перевязывают одну из лапок в области коленного сустава. Лягушку помещают в банку с водой. Через сутки животное демонстрируют на занятиях. Обращают внимание на объем интактной лапки и сравнивают с объемом перевязанной лапки.
Оформление протокола опыта. Отмечают отличительные признаки перевязанной лапки от интактной. Объясняют механизм развития отека лапки по Фишеру.
Постановка опыта 2. Набухание коллоидов в разных средах.
Оснащение: торзионные весы, бактериологические пробирки, штативы для пробирок, желатин (10 г), раствор соляной кислоты (0,01 моль/л) (100 мл), раствор соляной кислоты (0,1 моль/л) (100 мл), раствор натрия или калия гидроксида (0,1 моль/л) (100 мл), дистиллированная вода (100 мл).
Постановка опыта. Эксперимент ставят для объяснения механизма развития отека по Фишеру. В четыре пробирки наливают по 2-3 мл разных жидкостей: в пробирку № 1 — дистиллированную воду, в пробирку № 2 — раствор соляной кислоты (0,01 моль/л), в пробирку № 3 — раствор соляной кислоты (0,1 моль/л), в пробирку № 4 — раствор натрия или калия гидроксида (0,1 моль/л).
В каждую пробирку помещают пластинку желатина (фибрина), которую предварительно взвешивают на торзионных весах. Через 15 и 30 мин содержимое пробирки выливают в стаканчик, обтянутый марлей. Пластинку желатина с марли переносят на фильтровальную бумагу, а затем взвешивают. В одних пробирках определяют степень набухания желатина через 15 мин, а в других — через 30 мин. Устанавливают индекс набухания делением массы желатина через 15 и 30 мин пребывания в жидкости на массу желатина перед помещением в жидкость. Индексы набухания для кислоты и основания сравнивают с таким же показателем для дистиллированной воды.
Оформление протокола опыта. Составляют таблицу , в которую записывают массу кусочков желатина перед и после пребывания в растворе. Вычисляют индекс набухания. Сравнивают набухание желатина в растворах с набуханием в воде и делают выводы.
Вопросы для контроля знаний:
1. Классификация нарушений кислотно-щелочного равновесия. 2. Компенсированные ацидозы и алкалозы. 3. Ацидоз (алкалоз) декомпенсированный. 4. Механизм развития газового ацидоза или алкалоза. 5. Патогенез обменного (негазового) ацидоза или алкалоза. 6. Причины нарушения обмена углеводов. 7. Гипергликемия и ее виды. 8. Сахарный диабет. 9. Гипогликемический щок. 10. Обезвоживание организма. 14. Патологические процессы в желудочно-кишечном тракте у молодняка сельскохозяйственных животных, сопровождающиеся обезвоживанием. 15. Отек и водянка. 16. Механизм развития токсических отеков. 17. Роль первичной задержки электролитов в развитии отека. 18. Состав транссудата и его отличие от экссудата. 19. Патогенез застойных, почечных и сердечных отеков. 20. Патофизиологическое значение отека. 21. Гипокалиемия и гиперкалиемия. 22. Роль кальция в организме. 23. Нарушения минерального обмена при недостаточности паращитовидных желез.
Занятие 20. КОЛЛОКВИУМ № 3
Гипербиотические процессы в тканях и их характеристика (гипертрофия, гиперплазия, регенерация).
Опухоль, определение, этиология, особенности строения и физико-химические свойства.
Патогенез опухоли, характеристика стадий.
Основные признаки доброкачественных и злокачественных опухолей.
Гипобиотические процессы в тканях и их характеристика (атрофия, дистрофия, гипоплазия).
Некроз, гангрена, несовместимость тканей при трансплантации.
Нарушение эмбрионального развития.
Общие причины нарушения обмена веществ.
Нарушения кислотно-основного равновесия.
Компенсированные и декомпенсированные ацидозы и алкалозы.
Механизм развития газового ацидоза и алкалоза.
Ацидозы и алкалозы, их характеристика.
Нарушение обмена углеводов. Сахарный диабет. Гипогликемическая кома.
Нарушение обмена белков.
Нарушение обмена жиров. Кетоз.
Нарушение минерального обмена.
Нарушение обмена витаминов.
Нарушения вводно-электролитного обмена. Отёк и водянка, и их виды и механизм развития.
Механизм развития токсических отёков.
Роль первичной задержки электролитов в развитии отёка.
Состав транссудата и его отличие от экссудата.
Значение отека.
