
Часть молекул воды играет роль мостика и в других кристаллогидратах с нечетным числом молекул воды (NiSо47н2o, FеSo47н2o).
Встречаются также кристаллогидраты Сu (II), имеющие зеленую и темно-коричневую окраску. В этом случае кроме молекул воды роль лигандов играют соответствующие анионы. Так, в зеленом СuСl22Н2O атомы Сu окружены двумя молекулами воды и четырьмя атомами хлора (рис. 3).
При прибавлении воды СuСl22Н2O меняет окраску до голубой, т. е. при этом происходит образование аквокомплекса [Сu(OН2)6]2+.
Гидролиз солей Сu (II) часто сопровождается образованием малорастворимых в воде основных солей состава Сu(NO3)23Сu(ОН)2, СuSO42Сu(ОН)2, СuСl23Сu(ОН)2. Их можно рассматривать как производные оловых катионных комплексов. Большинство из этих соединений встречается в виде минералов.
Из других катионных комплексов меди (II) очень характерны комплексы с азотсодержащими лигандами, например [Сu(NН3)4(ОН2)2]2+ и хелатный [Сu(еn)2(ОН2)2]2+, константы нестойкости которых соответственно равны 110-13 и 310-21. Образованием аммиакатов, в частности, объясняется растворение Сu(ОН)2 в водных растворах аммиака:
Сu(ОН)2 (т) + 4NН3 (р) + 2Н2O (ж) = [Сu(NН3)4(ОН2)2](ОН)2 (р)
Замена в аквокомплексе [Сu(ОН2)6]2+ молекул воды на азотсодержащие лиганды приводит к появлению более интенсивной синей окраски:
Э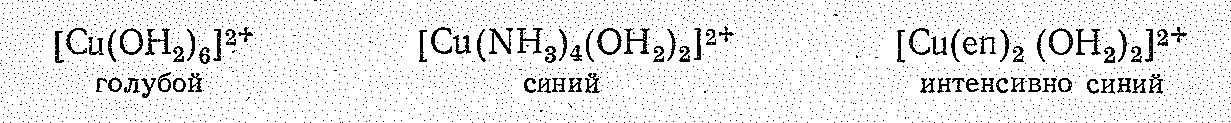 то
изменение цвета обязано усилению поля
лигандов в ряду ОН2—NН3—еn,
вызывающему смещение полосы поглощения
из далекой красной в среднюю красную
область спектра. (Максимум поглощения
иона [Сu(OН2)6]2+
наблюдается при ~800
нм, а у [Сu(NН3)4(ОН2)2]2+
при 600 нм). С другой стороны, СuSO4
бесцветен, так как поле иона SО42-
настолько слабое, что d—d-переходу
отвечает поглощение в инфракрасной
области.
то
изменение цвета обязано усилению поля
лигандов в ряду ОН2—NН3—еn,
вызывающему смещение полосы поглощения
из далекой красной в среднюю красную
область спектра. (Максимум поглощения
иона [Сu(OН2)6]2+
наблюдается при ~800
нм, а у [Сu(NН3)4(ОН2)2]2+
при 600 нм). С другой стороны, СuSO4
бесцветен, так как поле иона SО42-
настолько слабое, что d—d-переходу
отвечает поглощение в инфракрасной
области.
Соединения Сu (II) в общем устойчивее, чем однотипные производные Сu (I). Так, Сu(ОН)2 распадается на СuО и Н2O лишь при нагревании; разложение СuF2 и СuСl2 на СuНаl и Наl2 начинается соответственно при 950 и 500 °С. Однако СuI2 (G0 = —8,2 кДж/моль) разлагается уже при обычных температурах, переходя в СuI (G0 = —71 кДж/моль). Поэтому при попытке получения СuI2 по обменной реакции протекает окислительно-восстановительная реакция -
2Сu2+ (р) +4I- (р) = 2СuI (т) + I2 (т)
Аналогичным образом неустойчивы Сu(СN)2 и Сu(SСN)2:
2СuSО4 (р) + 4КСN (р) = 2СuСN (т) + (СN)2 (г) + 2К2SO4 (р)
Для меди (II) характерны также анионные комплексы купраты (II). Так, Сu(ОН)2 при нагревании в концентрированных растворах щелочей частично растворяется, образуя синие гидроксокупраты (II) типа М+12[Сu(ОН)4]. Некоторые из них выделены в свободном состоянии. В водных растворах гидроксокупраты (II) легко разлагаются, что свидетельствует о слабости кислотных свойств Сu(ОН)2.
В избытке основных галогенидов СuНаl2 образуют галогенокупраты (II) типа M+1[СuНаl3] и М+12[СuНаl4]. В отличие от Сu(СN)2 вполне устойчивы и хорошо растворимы в воде цианокупраты (II) типа М+12[Сu(СN)4]. Анионные комплексы Сu (II) ивестны также с карбонат-, сульфат- и другими анионами. Так, выделен темно-синий карбонатокупрат (II) калия К3[Сu(СO3)2]. Из растворов сульфатов щелочных металлов СuSO4 кристаллизуется в виде М1+2Сu(SO4)26Н2О.
Из производных серебра (II) более или менее устойчивы АgF2 и некоторые комплексные соединения с органическими лигандами. Соединения золота (II) неизвестны.
Из соединений меди (II) технически наиболее важен кристаллогидрат СuSО45Н2O (медный купорос). Он применяется для получения минеральных красок, для борьбы с вредителями и болезнями растений в сельском хозяйстве, служит исходным продуктом для получения меди и ее соединений и т. д.
Соединения Сu (III), Аg (III), Аu (III). Степень окисления + З наиболее характерна для золота. Диамагнетизм соединений золота (III) согласуется с участием в образовании связей 5d 6s 6р2-орбиталей иона Аu3+ (d8):
Э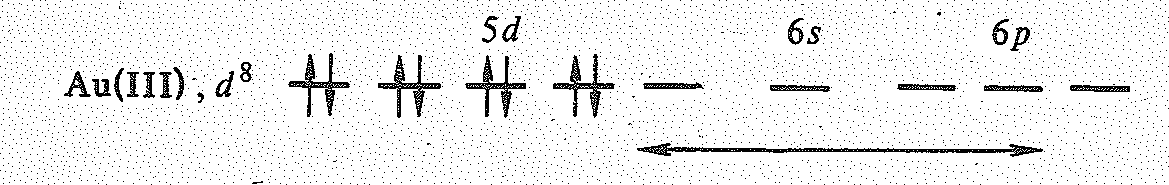 то
отвечает квадратной конфигурации
комплексов и структурных единиц
соединений золота (III).
то
отвечает квадратной конфигурации
комплексов и структурных единиц
соединений золота (III).
Из бинарных соединений Аu (III) известны:
В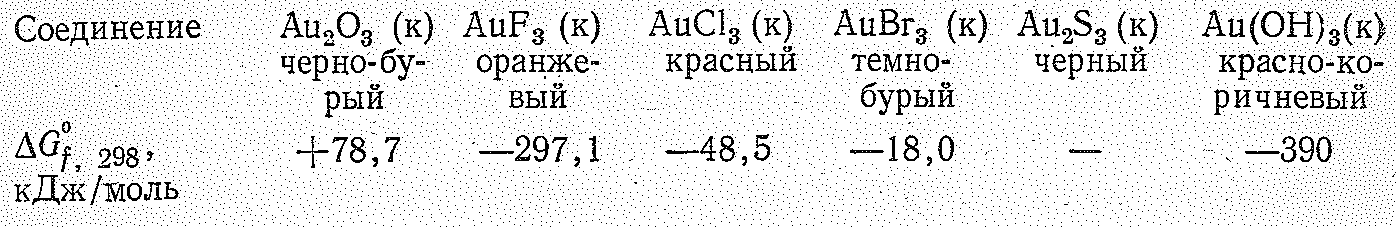
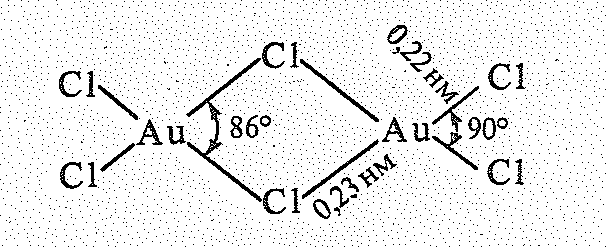 воде растворимы лишь АuСl3
и АuВr3,
состоящие из димерных плоских молекул:
воде растворимы лишь АuСl3
и АuВr3,
состоящие из димерных плоских молекул:
Основным исходным продуктом для получения других соединений золота является АuСl3, который получают взаимодействием порошка Аu с избытком Сl2 при 200 °С.
Галогениды, оксид в гидроксид Аu (III) — амфотерные соединения с преобладанием кислотных признаков. Так, Аu(ОН)3 легко растворяется в щелочах, образуя гидроксоаураты (III):
NаОН + Аu(ОН)3 = Nа[Аu(ОН)4]
Даже растворение в кислотах Аu(ОН)3 происходит за счет образования анионных комплексов:
Аu(ОН)3 + 4НNO3 = Н[Аu(NО3)4] + 3Н2O
Нитрато- и цианоаураты (III) водорода выделены в свободном состоянии. В присутствии солей щелочных металлов образуются нитрато-М+1[Аu(NO3)4], сульфато-М+1[Аu (SO4)2], циано-М+1 [Аu (СN)4], сульфидо-М+1[АuS2] и другого типа аураты (III).
Кислотный характер галогенидов Аu (III) проявляется в их исключительной склонности давать галогеноаураты (III) М+1[АuНаl4] (константа нестойкости иона [АuСl4]- равна 510-22). Большинство галогеноауратов (III) хорошо растворимо в воде и органических растворителях.
Особая склонность Аu (III) к образованию анионных комплексов проявляется и при гидролизе его тригалогенидов:
АuСl3 + Н2O Н[Аu(ОН)Сl3]
АuСl3 + Н2O Н2[АuOСl3]
Образующаяся при этом кислота Н2[АuОСl3] с ионами Аg+ дает труднорастворимую соль Аg2[АuОСl3], а не АgСl, что указывает на большую устойчивость иона [АuОСl3]2-.
Для Сu (III) и Аg (III) известны фторопроизводные: синий К3[СuF6] и желтый К[АgF4]. При окислении Сu(ОН)2 в щелочной среде получаются гидроксо- и оксокупраты (III) типа КСuО2 и К[Сu(OН)4]:
2Сu+2(ОН)2 + NaClO + 2NаОН = 2NаСu+3О2 + NаСl + 3Н2O
Степень окисления +3 у меди и серебра стабилизируется в комплексных иодатах (VП) и теллуратах (VI), например К7[Сu(IО6)2]7Н2O, Nа9[Сu(ТеО6)2] (коричневого цвета) и К6Н[Аg(IО6)2]10Н2O, Nа6Н3[Аg(ТеО6)2]20Н2О (желтого цвета). Соединения Сu (III) и Аg (III) — сильные окислители.
Все растворимые производные меди, серебра и золота ядовиты!
