
Т 15 л 21 d-элементы ib группы периодической системы
Медь Сu, серебро Аg и золото Аu каждый в своем периоде являются предпоследними d-элементами. Таким образом, в атомах элементов подгруппы меди в (n—1) d-состоянии должны находиться по девять электронов. Однако вследствие устойчивости d10-конфигурации энергетически оказывается более выгодным переход одного из s-электронов в (n—1)d-состояние. Поэтому Сu, Аg и Аu в s-состоянии внешнего слоя имеют по одному, а в предпоследнем слое по 18 (s2р6d10) электронов. Некоторые данные об элементах подгруппы меди приведены ниже:
У элементов подгруппы меди первая энергия
ионизации существенно выше, чем у
s-элементов
I
группы. Это объясняется проникновением
внешнего ns-электрона
под экран (n—1)d10-электронов.
Уменьшение первой энергии ионизации
при переходе от Сu
к Ag
обусловлено большим значением главного
квантового числа n,
дальнейшее же увеличение энергии
ионизации у Аu
обусловлено проникновением 6s-электрона
не только под экран 5d10-электронов,
но и под экран 4f14-электронов.
Что касается второй энергии ионизации
[удаление электрона из (n—1)d10-подслоя],
то у всех трех элементов она близка и
по значению заметно меньше, чем у щелочных
металлов.
элементов подгруппы меди первая энергия
ионизации существенно выше, чем у
s-элементов
I
группы. Это объясняется проникновением
внешнего ns-электрона
под экран (n—1)d10-электронов.
Уменьшение первой энергии ионизации
при переходе от Сu
к Ag
обусловлено большим значением главного
квантового числа n,
дальнейшее же увеличение энергии
ионизации у Аu
обусловлено проникновением 6s-электрона
не только под экран 5d10-электронов,
но и под экран 4f14-электронов.
Что касается второй энергии ионизации
[удаление электрона из (n—1)d10-подслоя],
то у всех трех элементов она близка и
по значению заметно меньше, чем у щелочных
металлов.
В соответствии со сказанным элементы подгруппы меди проявляют не только степень окисления +1, но и +2 и +3. для меди наиболее характерна степень окисления +2, для золота +3, а для серебра +1. Особая устойчивость степени окисления +1 у серебра объясняется относительно большей прочностью конфигурации 4d10, так как эта конфигурация образуется уже у палладия, предшествующего серебру в периодической системе.
Интересно отметить, что сродство к электрону у Сu, Аg и Аu значительно больше не только сродства к электрону s-элементов I группы, но даже кислорода в серы. Этот факт обязан эффекту проникновения s-электронов внешнего уровня к ядру.
Все это обусловливает большую склонность меди и ее аналогов к образованию ковалентной связи, чем у щелочных металлов.
Особенность электронной структуры атомов элементов подгруппы меди обусловливает относительно большую устойчивость двухатомных молекул Сu2, Аg2, Аu2 (энергия диссоциации соответственно 174,3, 157,5 и 210 кДж/моль) по сравнению с молекулами К2, Rb2, и Сs2 (энергия диссоциации порядка 40 кДж/моль). Прочность молекул Сu2, Аg2 и Аu2 обусловливается дополнительным -связыванием за счет свободных nр-орбиталей и (n—1)d-электронных пар.
Элементы подгруппы меди могут образовывать как катионные, так и анионные комплексы. Понятно, что по мере повышения степени окисления тенденция к образованию анионных комплексов возрастает.
Подгруппа меди
Из природных соединений меди наибольшее значение имеют минералы: медный колчедан (халькопирит) СuFеS2, медный блеск Сu2S, а также куприт Сu2О, малахит СuСО3Сu(ОН)2 и др. Серебро входит в состав сульфидных минералов других металлов (Рb, Zn, Сd и др.). для Сu, Аg и Аu довольно обычны также арсенидные, стибидные й сульфидарсенидные минералы. Медь, серебро и особенно золото встречаются в природе в самородном состоянии.
Простые вещества. Медь, серебро и золото представляют собой металлы (соответственно красного, белого и желтого цвета) с гранецентрированной кубической решеткой. Поскольку у меди и ее аналогов в образовании связи принимают участие как ns-, так и (n—1)d-электроны, то теплоты возгонки и температуры плавления у них значительно выше, чем у щелочных металлов. Медь, серебро и золото характеризуются исключительной (особенно, золото) пластичностью; они превосходят остальные металлы также по тепло- и электрической проводимости. Некоторые константы рассматриваемых металлов приведены ниже:
Химическая
активность меди и ее аналогов невелика
и убывает с возрастанием порядкового
номера элемента. Об этом, в частности,
свидетельствуют значения энергии Гиббса
образования их бинарных  соединений. Металлы легче всего реагируют
с галогенами (Сu
при обычной температуре, Аg
и Аu
при нагревании).
соединений. Металлы легче всего реагируют
с галогенами (Сu
при обычной температуре, Аg
и Аu
при нагревании).
С кислородом
непосредственно взаимодействует только
медь. При температуре красного каления
образуется СuО,
а при более высокой температуре Сu2O;
с серой непосредственно взаимодействуют
Сu
и 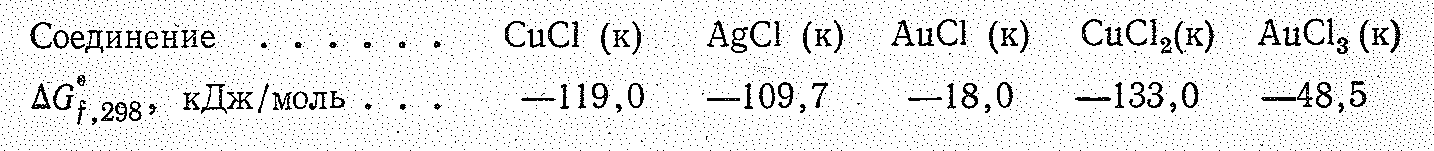 Ag:
Ag:
В следствие
окисления медь на воздухе покрывается
плотной зелено-серой пленкой основного
карбоната. При наличии в воздухе
сероводорода серебро покрывается черным
налетом Аg2S.
С водородом медь и ее аналоги не реагируют.
следствие
окисления медь на воздухе покрывается
плотной зелено-серой пленкой основного
карбоната. При наличии в воздухе
сероводорода серебро покрывается черным
налетом Аg2S.
С водородом медь и ее аналоги не реагируют.
Об уменьшении химической активности в ряду Сu—Аg—Аu свидетельствуют также значения стандартных электродных потенциалов. Поскольку Сu, Аg и Аu расположены в ряду напряжений после водорода, кислоты могут окислять их лишь за счет аниона: Сu и Аg растворяются в НNO3 и концентрированной Н2SO4, Аu — в горячей концентрированной Н2SеO4. Лучшим растворителем для золота являются насыщенный хлором раствор НСl и царская водка. Как в том, так и в другом случае взаимодействие происходит за счет окисления Аu атомарным хлором и образования анионного комплекса:
Аu + 3Сl + НСl = Н[АuСl4]
Аu + 4НСl = Н[АuСl4] + NO + 2Н2O
В отсутствие окислителей Сu, Аg и Аu устойчивы по отношению к щелочам.
Медь и ее аналоги растворяются в растворах основных цианидов в присутствии кислорода, например:
4Аuо + O2 + 8СN- + 2Н2O = 4[Аu+1(СN)2]- + 4OН-
Медь, кроме того, в присутствии кислорода растворяется в водных растворах аммиака:
4Cu0 + O2 + 8Н3N + 2Н2O = 4[Сu(NН3)2]+ + 4OН-
Друг другом и со многими другими металлами Сu, Аg и Аu образуют сплавы. Из сплавов меди наибольшее значение имеют бронзы (90%, Сu, 10% Sn), томпак (90% Сu, 10% Zn), мельхиор (68% Сu, 30% Ni, 1 % Мn, 1% Fе), нейзильбер (65% Сu, 20% Zn, 15% Ni), латунь (60% Сu, 40% Zn), а также монетные сплавы (95% Сu и 5% Аl — разменные монеты до 5 коп, 80% Сu и 20% Ni — монеты по 10 коп. и выше).
Для получения меди применяют пиро- и реже гидрометаллургические процессы. Пирометаллургический метод основан на частичном окислении сернистых руд до оксидов меди, которые затем восстанавливаются, реагируя с избытком сульфида:
2Сu2O + Сu2S = 6Сu + SO2
Пирометаллургический процесс извлечения меди из сернистых руд типа СuFеS2 можно выразить следующей суммарной реакцией:
2СuFеS2 + 5O2 + 2SiO2 = 2Сu + 2Fе SiO3 + 4SO2
Для отделения меди от железа и пустой породы медную руду обжигают на воздухе. При этом сульфиды железа переходят в FеО и выделяется SO2. Затем к образовавшемуся огарку добавляют кремнезем и кокс; шихту направляют на плавку. При плавлении шихты образуются две жидкие фазы. Верхний слой — сплав оксидов и силикатов (шлак), в который переходит часть железа (в виде FеSiO3) и компонентов пустой породы. Нижний — сплав сульфидов (штейн), в котором концентрируется медь (в основном в виде Сu2SFеS) и сопутствующие ей ценные элементы (Аu, Аg, Sе, Те, Ni и др.). Далее жидкий штейн подвергают окислительному обжигу, пропуская через него сжатый воздух. При этом происходит дальнейшее выгорание серы, переход железа в шлак и выделение металлической меди:
2(Сu2SFеS) + 5O2 + 2SiО2 = 4Сu + 2FеSiО3 + 4SO2
Образующийся при пирометаллургической переработке руды SO2 идет на производство серной кислоты, а шлак используется для производства шлакобетона, каменного литья, шлаковаты и пр. Получаемая пирометаллургическим методом медь обычно содержит 95—98 % Сu. Для получения меди высокой степени чистоты проводится электролитическое рафинирование электролизом СuSO4 с медным анодом. При этом сопутствующие меди благородные металлы, селен, теллур и другие ценные примеси концентрируются в анодном шламе, откуда их извлекают специальной переработкой.
Гидрометаллургические методы получения меди основаны на селективном растворении медных минералов обычно в разбавленных растворах Н2SО4 или аммиака. Из полученных растворов медь вытесняют железом либо выделяют электролизом.
Для отделения самородного золота от пустой породы применяют промывку водой, растворение Аu в жидкой ртути с последующей разгонкой амальгамы. Лучшим методом отделения золота от пустой породы является цианидный метод. Этот метод основан на растворении Аu в растворе NаСN за счет окисления кислородом воздуха и перехода в анионный комплекс Nа[Аu(СN)2] с последующим вытеснением из цианоаурата (I) цинком:
2Nа[Аu(СN)2] + Zn = Nа2[Zn(СN)4] + 2Аu
