
Т 12, 13 Л 19
d-ЭЛЕМЕНТЫ VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Хром Сr, молибден Мо и вольфрам W— d-элементы VI группы — образуют подгруппу хрома [ (n-1)d5s1 для Сr и Мо; (n-1)d4s2 для W ]

Как видно из приведенных данных, в ряду Сr—Мо—W увеличивается энергия ионизации, т. е: уплотняются электронные оболочки атомов, в особенности сильно при переходе от Мо к W. Последний вследствие лантаноидного сжатия имеет атомный и ионный радиусы, близкие к таковым у Мо. Поэтому молибден и вольфрам по свойствам ближе друг к другу, чем к хрому.
Характерные степени окисления хрома +3 (отвечает устойчивой несвязывающей электронной конфигурации d3) и в меньшей мере +6. У молибдена и вольфрама, как и у других 4d- и 5d-элементов, наиболее характерна высшая степень окисления, т. е. +6. Возможны также соединения, где хром и его аналоги проявляют степени окисления 0, +1, +2, +4 и +5.
Для хрома, молибдена и вольфрама наиболее типичны координационные числа 6 и 4. Известны также производные, в которых координационное число Мо и W достигает 8.
Как и для других s-элементов, для Сr, Мо и W при низких степенях окисления более характерны катионные комплексы, а при высоких — анионные комплексы. Так, дл Сr (III) возможны и катионные и анионные комплексы, тогда как для Сr (VI), Мо (VI) и W (VI) типичны анионные комплексы. В соответствии с этим, в частности, СrО основной оксид, Сr2O3 — амфотерный, а СrО3 — кислотный.
Подгруппа хрома
Природный хром состоит из четырех стабильных изотопов, молибден — из семи, вольфрам — из пяти. Большое число радиоактивных изотопов получено искусственно. Из минералов наибольшее значение имеют Fе(СrО2)2 хромистый железняк; МоS2 — молибденит, СаWO4 – шеелит, (Fе, Мn)WO4 — вольфрамит.
Наличие в почве следов молибдена необходимо для нормального развития растительных организмов. Особенно это относится к растениям семейства бобовых. Соединения молибдена, по-видимому, играют роль катализаторов процесса фиксации атмосферного азота.
Простые вещества. В виде простых веществ хром, молибден и вольфрам — серовато-белые блестящие металлы. Устойчивые в обычных условиях модификации Сr, Мо и W имеют структуру объемноцентрированного куба. Их основные константы приведены ниже:
В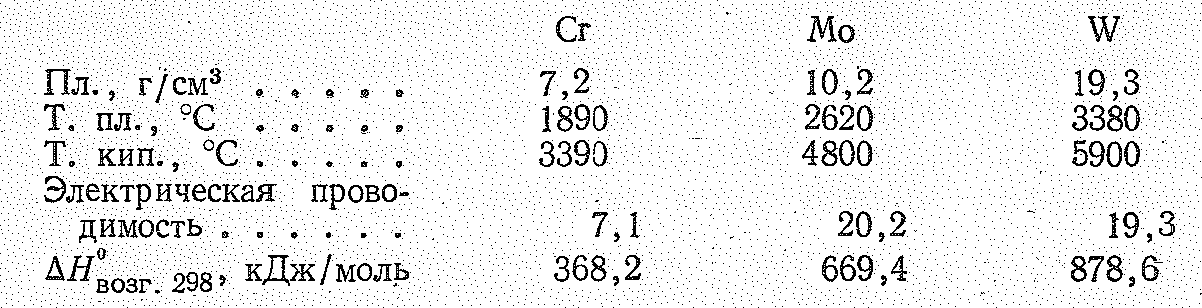 ольфрам
является самым тугоплавким из металлов.
В ряду Сr—Мо—W
наблюдается повышение температуры
плавления и теплоты атомизации (возгонки),
что объясняют усилением в металлическом
кристалле ковалентной связи, возникающей
за счет d-электронов.
На свойства металлов в большой степени
влияют примеси. Так, технический хром
— один из самых твердых металлов, в то
время как чистый хром пластичен.
ольфрам
является самым тугоплавким из металлов.
В ряду Сr—Мо—W
наблюдается повышение температуры
плавления и теплоты атомизации (возгонки),
что объясняют усилением в металлическом
кристалле ковалентной связи, возникающей
за счет d-электронов.
На свойства металлов в большой степени
влияют примеси. Так, технический хром
— один из самых твердых металлов, в то
время как чистый хром пластичен.
Как и в других подгруппах d-элементов, с ростом порядкового номера элемента в ряду Сr—Мо—W химическая активность заметно понижается. Так, хром вытесняет водород из разбавленных НСl и Н2SO4, тогда как вольфрам растворяется лишь в горячей смеси плавиковой и азотной кислот:
Э0+ 2НNO3 + 8НF = Н2[Э+6F8] + 2NO + 4Н2O
За счет образования анионных комплексов ЭО42- молибден и вольфрам взаимодействуют также при сплавлении со щелочами в присутствии окислителя:
Э0 + 3NаN+5О3 + 2NaOH = Nа2Э+6O4 + NaN+3O2 + Н2O
В концентрированных НNO3 и Н2SO4 хром пассивируется. При нагревании, в особенности в мелкораздробленном состоянии, Сr, Мо и W довольно легко окисляются многими неметаллами, например сгорают в кислороде:
2Сr (к) + 3/2 О2 (г) = Сr2O3 (к), Go298 = —1058 кДж/моль;
Мо (к) (W) + 3/2 O2 (г) = МоO3 (к) (WO3), Go298 = — 677 кДж/моль.
При этом образуются оксид хрома (III) и оксиды молибдена (VI) в вольфрама (VI), что соответствует устойчивым степеням окисления Сr и Мо, W. Образование СrО3 термодинамически менее выгодно, чем Сr2O3 (значение Go298 Сr2O3 в расчете на 1 моль О почти в два раза больше, чем у СrО3, Go298 Сr2O3 = —506 кДж/моль).
Хром легко пассивируется, поэтому широко используется в качестве гальванических защитных покрытий и для получения коррозионностойких сталей. Молибден применяется для изготовления химической аппаратуры, вольфрам - в электротехнической промышленности (в частности, для производства ламп накаливания), Молибден и вольфрам применяются в качестве катализаторов.
Относительно чистый хром получают методом алюмотермии:
Сr2O3 (к) + 2Аl (к) = 2Сr (к) + Аl2O3 (к), Go298 = —510 кДж/моль,
а молибден и вольфрам — восстановлением их оксидов водородом. В последнее время широкое распространение получил газофазный метод получения вольфрама за счет реакции взаимодействия галогенидов вольфрама с водородом при высокой температуре (1200 °С).
Для металлургии хром получают в виде сплава с железом (феррохром, содержащий до 60 % Сr) восстановлением хромистого железняка улем в электрической печи:
Fе+2(Сr+3О2)2 + 4С0 = Fе0 + 2Сr0 + 4С+2O
Выплавляют также ферромолибден и ферровольфрам, которые используются для получения высококачественных специальных сталей.
