Соединения элементов подгруппы марганца
Соединения Мn (0), Тс (0), Rе (0). Как указывалось, нулевая степень -окисления у d-элементов проявляется в соединениях с -донорными и -акцепторными лигандами. Так, для марганца и его аналогов известны карбонилы состава Э2(СО)10.
|
|
Эти соединения диамагнитны, следовательно, атомам марганца и его аналогов в степени окисления 0 можно приписать электронную конфигурацию d7.
Химическая связь М—СО в карбонилах металлов включает и -связи. -Связь образуется по донорно-акцепторному механизму за счет свободных орбиталей атома d-элемента и электронных пар углерода молекул СО. -Связь возникает по дативному механизму за счет свободных разр-орбиталей СО и d-электронных пар атома d-элемента. Так, Мn (0) за счет пяти свободных 3d4s4р3-орбиталей присоединяет пять молекул СО, образуя радикал Мn(CO)5. Устойчивость связи Мn—СО повышается за счет дативного -взаимодействия МСО, в котором принимают участие 3d-электронные пары атома марганца и разр-орбитали молекул СО. За счет непарных электронов атомов марганца возникает -связь Мn—Мn, поэтому радикалы Мn(СО)5 объединяются в молекулу Мn2(СО)10.
В обычных условиях желтый Мn2(СО)10 (Tпл. 155 °С), бесцветные Тс2 (СО)10 (Tпл. 160 °С) и Re2(СО)10 (Tпл. 177 oС) — твердые легко возгоняющие вещества.
Поскольку связь М—СО слагается из - и -связей, для образования кластерных карбонилов требуется большее число валентных электронов d-элемента, чем для образования кластерных галогенидов, у которых связь М—Hal преимущественно одинарная. Таким образом, если кластерные галогениды характерны для d-элементов V, VI и VII групп, то кластерные карбонилы чаще всего образуют d-элементы VII (Мn, Тс, Rе) и в особенности VIII группы (Fе, Ru и Оs; Со, Rh и Ir). Иными словами, кластерные карбонилы характерны для элементов у которых число валентных электронов превышает число электронов, необходимых для осуществления дативных -связей МСО.
Карбонилы металлов способны к реакциям замещения и окисле восстановления. Так, СО-группы в молекулах карбонилов могут замещаться на другие лиганды -донорного и акцепторного типа (РF3, РСl3, NO и др.), например Сr(РF3)3(СО)3.
В качестве примеров окислительно-восстановительных
реакций можно привести следующие:
качестве примеров окислительно-восстановительных
реакций можно привести следующие:
В первом случае [Мn(СО)5]2 восстанавливается во втором - окисляется что отвечает изменению степени окисления Мn от нуля до —1 и +1 соответственно.
Н иже
показаны d-элементы
которые образуют нейтральные бинарные
карбонилы и дают комплексы содержащие
помимо СО-групп атомы галогенов, например,
Мn(СО)5Вг:
иже
показаны d-элементы
которые образуют нейтральные бинарные
карбонилы и дают комплексы содержащие
помимо СО-групп атомы галогенов, например,
Мn(СО)5Вг:
Сплошной линией обведены символы d-элементов, образующих бинарные карбонилы; пунктирной линией — d-элементов, образующих карбонил-галогениды.
Известны и другие соединения нулевой степени окисления d-элементов например Сr(РF3)6, Мо(РF3)6, Сr(РF3)3(СО)3, Fе(NО)2(CO)2, Fе(NО)4, Ni[Р(С6Н5)3]4. В этих соединениях молекулы-лиганды выступают в качестве -доноров и -акцепторов электронных пар. Координационные числа d —элементов здесь также обусловливаются числом свободных орбиталей, возникающих при спаривании валентных электронов комплексообразователя.
Соединения Мn (II), Тс (II), Rе (II). Для марганца (II) характерно координационное число шесть, что соответствует октаэдрическому расположению связей. Соединения Мn (II) парамагнитны и, за исключением цианидов, содержат пять непарных электронов. Строение высокоспиновых октаэдрических комплексов Мn (II) со ответствует следующей электронной конфигурации:
|
|
Бинарные соединения марганца (II) — кристаллические вещества с координационной или слоистой решеткой. Например, МnО и МnS имеют структуру типа NаСl, к структурному типу рутила относится МnF2, слоистую структуру имеют МnСl2, Мn(ОН)2.
Большинство солей Мn (II) хорошо растворимы в воде. Малорастворимы МnО, МnS, МnF2, Мn(ОН)2, МnСО3 и Мn3(РО4)2. При растворении в воде соли Мn (II) диссоциируют, образуя аквокомплексы [Мn(ОН2)6]2+, придающие растворам розовую окраску. Такого же цвета кристаллогидраты Мn (II), например Мn(NО3)26Н2O, Мn(СlO4)26Н2O.
В
 кристаллогидратах с меньшим числом
молекул воды роль лигандов, помимо
ОН2-групп, играют их анионные
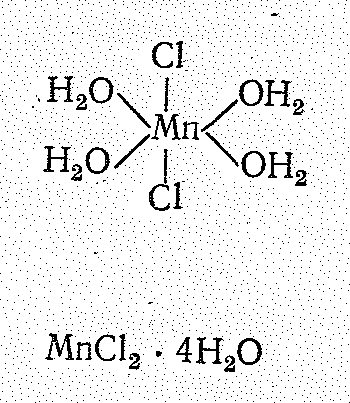
составляющие. Например, в МnСl22Н2О
и МnСl24Н2О
октаэдрическое окружение Мn (II) возникает
за счет молекул воды и атомов хлора; а
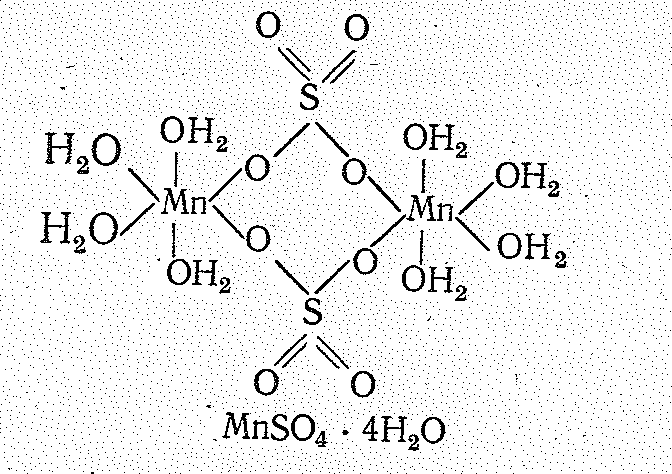
в кристаллогидрате МnSO44Н2О
группа SО4, играет роль связующего
мостика между атомами Мn (II):
кристаллогидратах с меньшим числом
молекул воды роль лигандов, помимо
ОН2-групп, играют их анионные
составляющие. Например, в МnСl22Н2О
и МnСl24Н2О
октаэдрическое окружение Мn (II) возникает
за счет молекул воды и атомов хлора; а
в кристаллогидрате МnSO44Н2О
группа SО4, играет роль связующего
мостика между атомами Мn (II):
|
По химическим свойствам бинарные соединения Мn (II) амфотерны (преобладают признаки основных соединений). В реакциях без изменения степени окисления для них наиболее характерен переход в катионные комплексы. Так, оксид МnО, как и гидроксид Мn(ОН)2, легко взаимодействует с кислотами. Со щелочами же они реагируют только при достаточно сильном и длительном нагревании: |


Из гидроксоманганатов (II) выделены в свободном состоянии К4[Мn(ОН)6], Ва2[Мn(ОН)6] (красного цвета) и некоторые другие. Все они в водных растворах полностью разрушаются. По этой же причине ни металлический марганец, ни его оксид и гидроксид в обычных условиях со щелочами не взаимодействуют.
Оксид МnО (серо-зеленого цвета, Tпл. 1780 oС) имеет переменный состав (МnО—МnО1,5), обладает полупроводниковыми свойствами. Его обычно получают, нагревая МnO2 в атмосфере водорода или термически разлагая МоСО3.
Поскольку МnО с водой не взаимодействует Мn(ОН)2 (белого цвета) получают косвенным путем — действием щелочи на раствор соли Мn (II):
MnSO4 (р) + 2КОН (р) == Мn(ОН)2 (т) + К2SO4 (р)
Известны также аммиакаты Мn (II), например [Мn(NН3)6]Сl2, [Мn(NН3)6](СlО4)2. Аммиакаты легко разрушаются водой:
[Мn(NН3)6]Сl2 + 2Н2О Мn (ОН)2 + 2NН4Сl + 4Н3N
и могут существовать лишь в твердом состоянии или в растворах с большим избытком аммиака и солей аммония.
Кислотные признаки соединения Мn (II) проявляют при взаимодействии с однотипными производными щелочных металлов. Так, нерастворимый в воде Мn(СN)2 (белого цвета) за счет комплексообразования растворяется в присутствии КСN:
4КNС + Мn(СN)2 = К4[Мn(СN)6]
гексацианоманганат (II)
Аналогичным образом протекают реакции
4КF + МnF2 = К4[МnF6]
гексафтороманганат (II)
2КСl + МnСl2 = К2[МnСl4]
тетрахлороманганат (II)
Большинство манганатов (II) (кроме комплексных цианидов) в разбавленных растворах распадается.
Манганаты (II) часто образуют кристаллогидраты, например, К2[МnСl4]2H2O, K2Мn(SO4)24Н2O. Последние состоят из октаэдрических комплексов типа [МnСl4(OН2)2]2- и [Мn(SO4)2(OH2)4]2-.
При действии окислителей производные Мn (II) проявляют восстановительные свойства. Так, в щелочной среде Мn(ОН)2 легко окисляется даже молекулярным кислородом воздуха, поэтому осадок Мn(ОН)2, получаемый по обменной реакции, быстро темнеет:
6Mn+2 (OH)2 + O2 = 2Мn2Мn+4O4 + 6H2O
В сильнощелочной среде окисление сопровождается образованием оксоманганатов (VI) — производных комплекса МnО42-:
3Mn+2SO4 + 2KCl+5O3 + 12KOH ====== 3K2Mn+6O4 + 2KCl-1 + 3K2SO4 + 6H2O
сплавление
Сильные окислители, такие, как РbО2 (окисляет в кислой среде), переводят соединения Мn (II) в оксоманганаты (VII) — производные комплекса МnО4-:
2Мn+2SО4 + 5Рb+4O2 + 6НNO3 = 2HМn+7O4 + 3Рb+2 (NO3)2 + 2Рb+2SO4 + 2Н2O
Последняя реакция используется в аналитической практике как качественная реакция на соединения марганца.
Соединения Тс (II) и Rе (II) не характерны.
Соединения Мn (IV), Тс (IV), Rе (IV). Как указывалось, для ионов с конфигурацией d3 наиболее характерны октаэдрические комплексы с распределением валентных электронов по орбиталям: [св]12 [d]3. Таким образом, для Э (IV) наиболее характерно координационное число шесть. Можно привести лишь несколько примеров устойчивых соединений марганца (IV). Это диоксид МnО2, тетрафторид МnF4. Относительно устойчивы также производные гексагалогеноманганат (IV)-комплексов типа МnF62- и МnСl62-, в то время как МnСl4 легко разлагается, а МnF4 очень реакционноспособен.
Диоксид МnO2 черно-бурое твердое вещество, обычно переменного состава. Это наиболее устойчивое соединение марганца, оно широко распространено в земной коре (пиролюзит и др.). Кристаллы МnO2 построены по типу кристаллов рутила. При обычных условиях МnO2 в воде не растворяется и довольно инертен — без нагревания устойчив к действию большинства кислот.
По химической природе МnO2 амфотерен. Так, известна черная соль Мn(SO4)2, получаемая окислением МnSO4. В водных растворах это соединение гидролизуется нацело. При сплавлении со целочами или основными оксидами, например
МnО2 + СаО = СаМnО3
образуются оксоманганаты (IV) (манганиты) весьма разнообразного и сложного состава. Простейшие из манганитов М+2 МnО3 и М+14МnО4.
Соединения Мn (IV) — сильные окислители:
МnО2 + 4Н+ + 2е = Мn2+ + 2Н2O, Е0298 = 1,23 В
Так при нагревании с кислотами МnО2 не образует аквокомплексы, а проявляет окислительные свойства, например окисляет концентрированную соляную кислоту:
Мn+4О2 + 4НСl—1 = Мn+2Сl2 + Сl02 + 2Н2O
Диоксид марганца при взаимодействии с горячей Н2SO4 или НNO3 разлагается с выделением кислорода. В качестве дешевого окислителя МnО2 широко используется в технике и лабораторной практике. В стекольном производстве применяется для обесцвечивания стекла, используется в спичечном производстве.
При взаимодействии соединений марганца (IV) с наиболее сильными окислителями образуются производные Мn (VI) и Мn (VII), например:
3Мn+4О2 + КСI+5О3 + 6КОН ==== 3К2Мn+6О4 + КСl-1 + 3Н2O
сплавление
2Мn+4О2 + 3Рb+4О2 + 6НNО3 = 2НМn+7О4 + 3Рb+2 (NO3)2 + 2Н2О
для Тс (IV) и Rе (IV) известны соединения типа ЭО2, ЭНаl4, М+12ЭO3 и М+12ЭНаl6. Производные Тс (IV) относительно устойчивее однотипных соединений Мn (IV) и Rе (IV).
Соединения Мn (VI), Тс (VI), Rе (VI). Соединения, в которых степень окисления марганца и его аналогов +6, немногочисленны. Из них более устойчивы соединения рения и технеция, для которых известны фториды и хлориды, ряд оксогалогенидов и оксиды, например:

Галогениды, оксогалогениды и оксиды Тс (VI) и Rе (VI) — кислотные соединения. Им соответствуют анионные комплексы, например:

Так, жидкий RеF6 взаимодействует с фторидами щелочных металлов с образованием солей нона RеF82-:
2КF + RеF6 = К2[RеF8]
Производные ионов [ЭOF5]- и [ЭO4]2- получают косвенным путем. Степень окисления +6 марганца несколько стабилизируется в анионе МnO42-, называемом манганатом. Производные МnO42-, ТсО42- и RеО42- (темно-зеленого цвета) в водных растворах существуют лишь при большом избытке щелочи, в противном случае диспропорционируют по схеме
3Э+6О42- + 2Н2О =2Э+7О4- + Э+4О2 + 4ОН-
Особо легко этот процесс, происходит в кислой среде, поэтому производные водорода типа Н2ЭО4 не образуются.
Диспропорционированием сопровождается также гидролиз галогенидов и оксогалогенидов Тс (VI) и Rе (VI), протекающий весьма энергично с образованием НЭО4, ЭO2 и ННаl. При взаимодействии ЭO3, ЭОНаl4, ЭF4, ЭСl6 со щелочами образуются соответствующие соли и ЭO2 например:
3Э+6Сl6 + 20КОН = 2КЭ+7O4 + Э+4O2 + 18КСl + 10Н2O
Соединения Мn (VI) — сильные окислители, в особенности в кислой среде:
МnO42- + 4Н+ + 2е = МnО2 + 2Н2O, E0298 = 2,2 В
Однако при действии более сильных окислителей они превращаются в оксоманганаты (VII):
2К2Мn+6О4 + С120 = 2КМn+7О4 + 2КСl-1
Производные Тс (VI) и Rе (VI), наоборот, легко окисляются даже молекулярным кислородом воздуха:
4К2Э+6О4 + О2 + 2Н2О = 4КЭ+7О4 + 4КОН
Соединения Мn (VII), Тс (VII), Rе (VII). Устойчивость соединений в ряду - Мn (VII), Тс (VII) и Rе (VII) повышается. Так, для Мn (VII) известны лишь оксид Мn2О7 и оксофторид МnО3F, а для Rе (VII) получена вся гамма соединений ряда RеF7—RеОF5—RеО2F3—RеО3F—Rе2О7. Сведения о некоторых соединениях Мn (VII) и Rе(VII) приведены ниже:
М арганцу
(VII),
технецию (VII)
и рению (VII)
отвечают устойчивые анионные
тетраэдрические комплексы типа ЭО4-.
Максимальное координационное число
рения проявляется в соединениях К2[RеF9]
и К2[RеН9].
арганцу
(VII),
технецию (VII)
и рению (VII)
отвечают устойчивые анионные
тетраэдрические комплексы типа ЭО4-.
Максимальное координационное число
рения проявляется в соединениях К2[RеF9]
и К2[RеН9].
О повышении устойчивости однотипных
производных в ряду Мn
(VII)—Тс
(VII)—Rе
(VII)
свидетельствует характер изменения
энтальпии Нf0
и энергии Гиббса образования G0f
соединений. При этом значения G0f
и Нf0
для соединений Тс (VII)
и Rе
(VII)
оказываются близкими (следствие
лантаноидного сжатия) и заметно более
высокими, чем для однотипных соединений
Мn
(VII),
например:
повышении устойчивости однотипных
производных в ряду Мn
(VII)—Тс
(VII)—Rе
(VII)
свидетельствует характер изменения
энтальпии Нf0
и энергии Гиббса образования G0f
соединений. При этом значения G0f
и Нf0
для соединений Тс (VII)
и Rе
(VII)
оказываются близкими (следствие
лантаноидного сжатия) и заметно более
высокими, чем для однотипных соединений
Мn
(VII),
например:
Оксид марганца (VII) Мn2O7 (Нf0 = —743 кДж/моль) — неустойчивая зеленовато-черная маслянистая жидкость. Его получают действием концентрированной Н2SO4 на манганаты (VII):
2КМnO4 + Н2SO4 = Мn2O7 + К2SO4 + Н2O
Если не применять специальных мер, Мn2O7 разлагается со взрывом:
2 Мn2O7 = 4МnO2 + 3O2
Оксид технеция (VII) Тс2O7 (Нf0 = —1117 кДж/моль) и оксид рения (VII) Rе2О7 (Нf0 = —1243 кДж/моль) — устойчивые кристаллические вещества желтого цвета, Их можно получить непосредственным окислением простых веществ.
В обычных условиях МnО3F — жидкость. Его молекула имеет форму искаженного тетраэдра с атомом марганца в центре ( = 0,510-20 Клм):
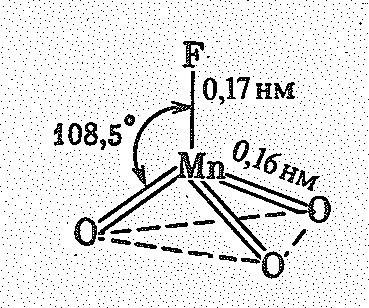
Аналогичным образом построены молекулы RеО3Наl и ТсО3Наl.
Г алогениды,
оксогалогениды и оксиды Э (VII)
— типичные кислотные соединения. Они
энергично взаимодействуют с водой с
образованием кислот:
алогениды,
оксогалогениды и оксиды Э (VII)
— типичные кислотные соединения. Они
энергично взаимодействуют с водой с
образованием кислот:
Тетраоксоманганат (VII) водорода НМnО4 в свободном состоянии не получен, максимально возможная концентрация его водных растворов 20%. Тетраоксотехнат (VII) водорода НТсО4 — красное кристаллическое вещество, тетраоксоренат (VII) водорода НRеО4 не выделен. В водных растворах НЭО4 являются сильными кислотами, называемыми соответственно марганцовой, технециевой и рениевой. В ряду НМnО4—НТсО4—НRеО4 сила кислот несколько уменьшается.
Большинство производных МnO4-, ТсO4- и RеО4- (неудачно называемые еще перманганатами, пертехнатами и перренатами) хорошо растворимо в воде. Сравнительно трудно растворимы соли К+, Rb+ и Сs+. Ион МnО4- красно-фиолетового, ТсO4- розового цвета, RеО4- бесцветен.
Соединения марганца (VII) сильные окислители. Например, при соприкосновении с Мn2O7 эфир и спирт воспламеняются. Тетраоксоманганаты (VII) в качестве сильных окислителей широко применяются в лабораторной практике. Возможны следующие направления восстановления нона МnO4-,
В кислой среде образуются катионные
комплексы типа [Мn(ОН2)6]2+,
в сильнощелочной среде — анионы МnО42-,
в нейтральной и щелочной — производные
Мn
(IV),
обычно МnO2.
кислой среде образуются катионные
комплексы типа [Мn(ОН2)6]2+,
в сильнощелочной среде — анионы МnО42-,
в нейтральной и щелочной — производные
Мn
(IV),
обычно МnO2.
При нагревании оксоманганаты (VII) распадаются:
2КМnО4 = К2МnО4 + МnО2 + O2
Эта реакция используется в лаборатории для получения кислорода.
П риведенный
обзор показывает, что ионы МnO4-
устойчивее ионов МnO42-.
Этот факт в рамках теории молекулярных
орбиталей можно объяснить следующим
образом. Ион МnO4-
содержит 24 валентных электрона: 7
электронов атома Мn
(3d54s2),
16 электронов четырех атомов О (2р4)
и 1 электрон на счет заряда иона. Ион
МnO42-,
имеющий заряд на единицу больше, содержит
уже 25 электронов. Распределение валентных
электронов по молекулярным орбиталям
ионов МnO4-
и МnO42-
соответствует следующим электронным
конфигурациям:
риведенный
обзор показывает, что ионы МnO4-
устойчивее ионов МnO42-.
Этот факт в рамках теории молекулярных
орбиталей можно объяснить следующим
образом. Ион МnO4-
содержит 24 валентных электрона: 7
электронов атома Мn
(3d54s2),
16 электронов четырех атомов О (2р4)
и 1 электрон на счет заряда иона. Ион
МnO42-,
имеющий заряд на единицу больше, содержит
уже 25 электронов. Распределение валентных
электронов по молекулярным орбиталям
ионов МnO4-
и МnO42-
соответствует следующим электронным
конфигурациям:
Как видим, во втором ионе один из валентных электронов занимает разрыхляющую молекулярную орбиталь. Поэтому ион МnO42- довольно легко окисляется. Еще менее устойчивы ионы МnO43- и МnO44-.
Из соединений элементов подгруппы марганца наибольшее применение имеет МnО2. Это исходный продукт для получения всех остальных производных марганца. Диоксид применяют также в качестве катализатора, дешевого окислителя, деполяризатора в гальванических элементах и т. д.