Т 17 л 23 d-элементы ivb, vb группы периодической системы
d -Элементы
IV
группы — титан Тi,
цирконий Zr,
гафний Hf,
резерфордий Rf
— полные
электронные аналоги, образуют подгруппу
титана.
-Элементы
IV
группы — титан Тi,
цирконий Zr,
гафний Hf,
резерфордий Rf
— полные
электронные аналоги, образуют подгруппу
титана.
Как видно из приведенных данных, в ряду- Тi—Zr—Нf несколько увеличиваются первые энергии ионизации. При переходе от Тi к Zr возрастают атомные и ионные радиусы, а цирконий и гафний из-за лантаноидного сжатия имеют почти одинаковые размеры атомов и ионов. Поэтому свойства Zr и Hf очень близки и их разделение одна из сложнейших проблем неорганической технологии,
В отличие от элементов подгруппы германия в подгруппе титана с ростом порядкового номера устойчивая степень окисления повышается. Для титана и его аналогов наиболее характерна степень окисления +4, но известны также соединения Тi (III) и реже Тi (II). Так, для титана устойчивы оксиды ТiО, Тi2О3, ТiО2 и фториды ТiF2, ТIF3, ТiF4, а для циркония и гафния — ZrО2, HfO2 и ZrF4, НfF4. Этот экспериментальный факт на примере фторидов можно объяснить следующим образом. Образование соединений из простых веществ сопровождается затратой энергии для разрыва связей в простых веществах и выделением энергии при взаимодействии образовавшихся атомов. Энергия разрыва связей в металле (теплота атомизации) значительно больше, чем энергия разрыва связей в неметалле (F2). При образовании ЭF2, ЭF3, ЭF4 затрата энергии на атомизации металла одна и та же. Но выигрыш энергии при присоединении атомов Э и F в случае образования ЭF2 меньше, чем в случае образования ЭF3 и ЭF4. Следовательно, если энергия атомизации металла достаточно велика, то энергетически более выгодно, когда образуются высшие, а не низшие фториды. Поскольку в подгруппах d-элементов теплота атомизации (возгонки) с увеличением порядкового номера элемента возрастает, то энергетически более выгодными становятся фториды высших степеней окисления элемента.
Для титана типично координационное число 6 и реже 4; для циркония и гафния высшие координационные числа 7 и 8.
Подгруппа титана
Природные титан и цирконий имеют пять изотопов, гафний —шесть. Резерфордий синтезирован в лаборатории. В земной коре титан довольно распространен, встречается главным образом в виде минералов рутила ТiО2, ильменита FеТiО3 и перовскита СаТiО3. Цирконий и гафний рассеянные элементы; из наиболее важных минералов циркония можно назвать циркон ZrSiО4 и бедделеит ZrО2. Гафний самостоятельных минералов не образует, а всегда сопутствует цирконию.
Простые вещества. В виде простых веществ титан, цирконии и гафний серебристо-белые металлы. Титан относится к легким, а цирконий и гафний к тяжелым металлам. Все они тугоплавки. В обычных условиях у них устойчива -модификация (гексагональная решетка), а при высоких температурах — -модификация (кубическая объемноцентрированная решетка). Основные константы рассматриваемых простых веществ приведены ниже:
Ч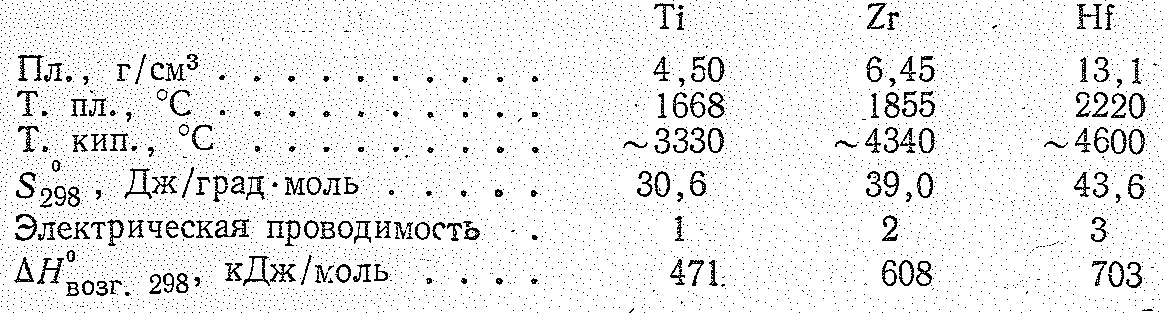 истые
металлы хорошо поддаются механической
обработке. Следует отметить, что у
металлов, содержащих в качестве примесей
О, N,
C,
H,
пластичность, ковкость, тягучесть,
твердость, прочность на разрыв и другие
механические характеристики резко
изменяются.
истые
металлы хорошо поддаются механической
обработке. Следует отметить, что у
металлов, содержащих в качестве примесей
О, N,
C,
H,
пластичность, ковкость, тягучесть,
твердость, прочность на разрыв и другие
механические характеристики резко
изменяются.
При обычной температуре металлы коррозионноустойчивы на воздухе, что объясняется наличием на их поверхности защитной пленки ЭO2. При нагревании же их активность заметно возрастает. Так, при температуре красного каления они сгорают в кислороде, образуя ЭO2. При 800 °C активно реагируют с азотом, образуя ЭN. С галогенами взаимодействуют при 150—400 °C, образуя ЭНаl4 и т. д. В порошкообразном состоянии металлы пирофорны.
Титан, цирконий и гафний химически устойчивы во многих агрессивных средах. В частности, титан устойчив против действия растворов сульфатов, хлоридов, морской воды и др. В НNО3 все они пассивируются. В отличие от циркония и гафния титан при нагревании растворяется в соляной кислоте, образуя в восстановительной атмосфере Н2 аквокомплексы Тi (III) — [Тi(ОН2)6]3+
2Тi0 + 6OH3+ + 6Н2O = 2[Тi+3 (ОН2)6]3+ + 3Н2
Цирконий и гафний взаимодействуют с кислотами лишь в тех случаях, когда создаются условия их окисления и образования анионных комплексов Э (IV). Так, мелкораздробленные Zr и Нf, как и Тi, относительно легко растворяются в плавиковой кислоте:
Э0 + 6НF = Н2[Э+4F6] + 2Н2
в смеси кислот НF + НNО3, в концентрированной H2SO4 и в царской водке:
3Э0 + 4HNО3 + 18НF = 3Н2[Э+4F6] + 4NО + 8Н2O
Zr0 + 5Н2SO4 = Н2[Zr+4 (SО4)3] + 2SO2 + 4Н2O
3Zr0 + 4НNO3 + 18НСl = 3Н2[Zr+4Сl6] + 4NO + 8Н2O
Цирконий и гафний, в меньшей степени титан, устойчивы в растворах щелочей.
Поскольку при высоких температурах Тi, Zr и Hf проявляют высокую химическую активность, выделение их в чистом виде представляет значительные трудности. Обычно эти металлы получают магнийтермическим и натрийтермическим восстановлением тетрагалогенидов в атмосфере аргона или гелия:
ТiСl4 + 2Мg = 2МgСl2 + Тi
К2[ZrF6] + 4Nа = 4NаF + 2КF + Zr
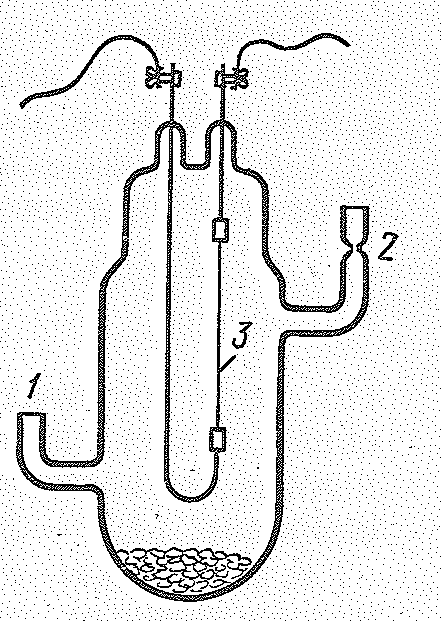
Очень чистые металлы получают термическим разложением тетраиодидов ЭI4 при высокой температуре в вакууме. На рис. 1 изображен сосуд из стекла пирекс для получения чистого титана. Через отверстие 1 поступают порошкообразный титан и иод, через отверстие 2 откачивают воздух. В ходе процесса сосуд нагревают до 600 °C в электрической печи, а титановая проволока 3 нагревается электрическим током. При 200 °C титан и иод взаимодействуют с образованием ТiI4, который при 377 °C сублимирует. Пары ТiI4 при соприкосновении с титановой проволокой, нагретой до 1100—1400° с, разлагаются: металлический титан оседает на проволоку, а пары иода конденсируются на холодных частях прибора. Таким путем удается получать титан очень высокой степени чистоты, поскольку большинство примесей, содержащихся в исходном металле, или не реагирует с иодом, или не образует летучих при 377 °C иодидов. Таким путем титан получают в виде прутиков диаметром 5 – 30 мм. Используемые в металлургии титан и цирконий получают в виде ферротилана и ферроциркония (15—50% Тi или Zr) путем совместного восстановления углем минералов титана или циркония и железных руд.
|
Рис. 1. Сосуд для получения титана термическим разложением ТiI4. |
Титан благодаря высокой термической и коррозионной устойчивости — важный конструкционный материал. Он используется для строительства самолетов, подводных лодок и пр. Цирконий (освобожденный от гафния) и его некоторые сплавы применяются в атомной энергетике в качестве конструкционных материалов, отражающих нейтроны. Масштабы применения гафния более ограничены: он также используется в атомной энергетике, но как поглотитель нейтронов; применяется в электронной технике (катоды телевизионных трубок).