Т 8 л 14 р- Элементы III группы Периодической системы
К р-элементам III группы относятся типические элементы — бор и алюминий — и элементы подгруппы галлия — галлий, индий и таллий:
2 период В 1s22s22p1
3 период Al 1s22s22p63s23p1
4 период Ga 3s23p63d104s24p1
5 период In 4s24p64d105s25p1
6 период Tl 4s24p64d105s25p65d106s26p1
Некоторые константы этих элементов приведены ниже:
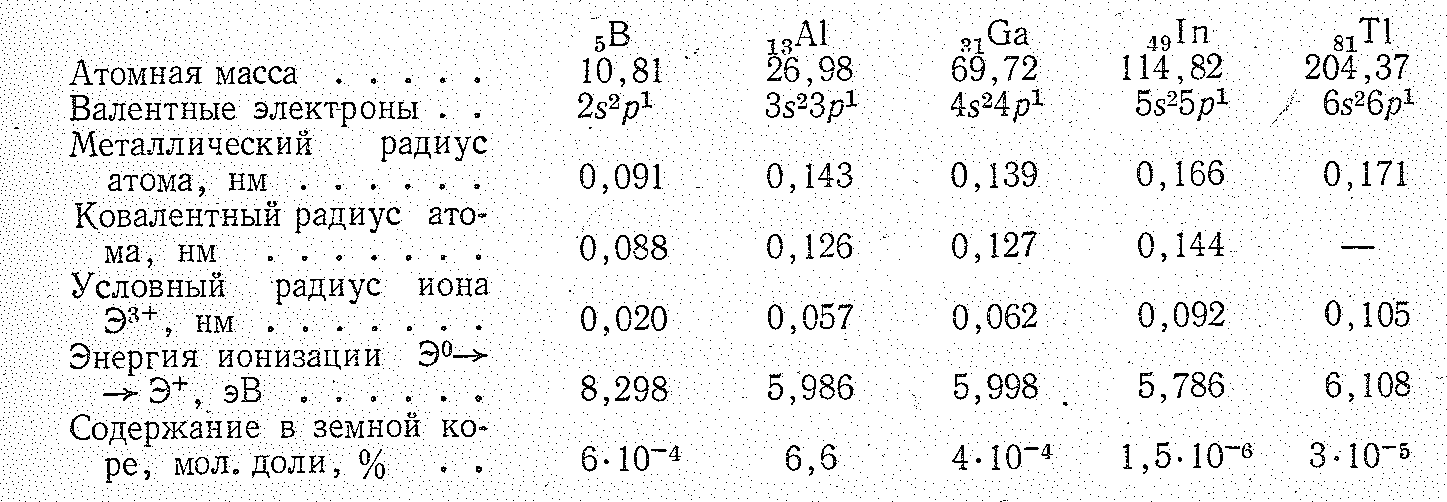
Как видно из приведенных данных, с увеличением порядкового номера элементов энергия ионизации атомов уменьшается: бор — неметалл, таллий — типичный элемент-металл.
Бор
По сравнению с ранее рассмотренными элементами 2-го периода у бора наблюдается дальнейшее ослабление признаков неметаллического элемента. В этом отношении он напоминает кремний (диагональное сходство в периодической системе). для бора наиболее характерны соединения, в которых его степень окисления равна +3. Отрицательные степени окисления бора проявляются редко; с металлами бор обычно образует нестехиометрические соединения.
Бор в земной коре (610-4 мол. доли, %) находится в виде двух изотопов: 10В (19,57 %) и 11В (80,43 %). Основными его минералами являются бораты: Nа2В4О7IОН2О — бура, Nа2В4О74Н2O - кернит, Н3В3О3 - сассолин.
Относительно невысокое содержание бора в земной коре, не отвечающее его малому порядковому номеру, объясняется легкостью взаимодействия его ядер с нейтронами: 105В + 10n = 42Не + 73Li
Эта способность бора поглощать нейтроны определяет важную роль борсодержащих материалов в ядерной энергетике в качестве замедлителей ядерных процессов и в биологической защите.
П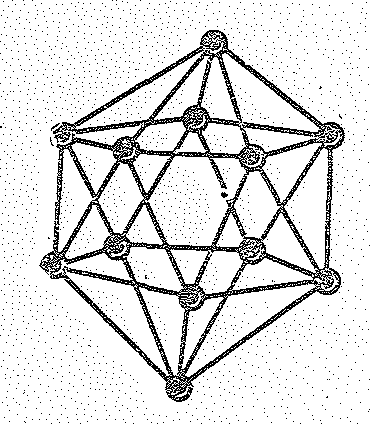 ростые
вещества.
Бор имеет несколько аллотропических
модификаций. Атомы бора в них объединены
в группировки В12,
имеющие форму икосаэдра-двадцатигранника.
ростые
вещества.
Бор имеет несколько аллотропических
модификаций. Атомы бора в них объединены
в группировки В12,
имеющие форму икосаэдра-двадцатигранника.
Икосаэдрическая группировка атомов В12
Расположение икосаэдров относительно друг друга в кристалле показано ниже:
Кристаллы бора черного цвета, тугоплавкие (Tпл. 2300 °С, Tкип. 2550 oС), диамагнитны, обладают полупроводниковыми свойствами (Е = 1,55 эВ).
В обычных условиях бор (подобно кремнию) весьма инертен и непосредственно взаимодействует только со фтором; при нагревании (400—700 °С) окисляется кислородом, серой, хлором и даже азотом (выше 1200 °С). С водородом бор не взаимодействует. При сильном нагревании восстановительная активность бора проявляется и в отношении таких устойчивых оксидов, как SiO2, Р2O5 и др.:
3SiO2 + 4В = 3Si + 2В2O3
Это объясняется высоким значением энергии Гиббса образования оксида бора В2O3 (Go298 = –1178 кДж/моль).
На бор действуют лишь горячие концентрированные азотная и серная кислоты, а также царская водка, переводя его в Н3ВО3. Щелочи при отсутствии окислителей на бор не действуют.
В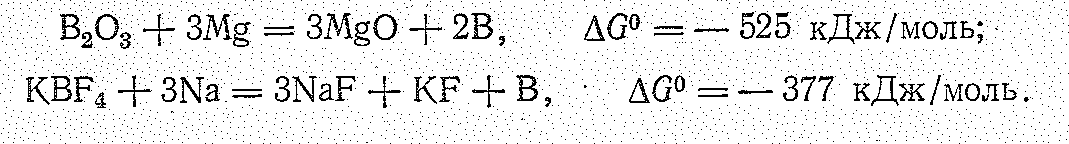 следствие
высокой энергии Гиббса образования
большинства соединений бора его получение
в свободном состоянии производится
обычно методами металлотермии
(чаще всего восстановлением магнием
или натрием):
следствие
высокой энергии Гиббса образования
большинства соединений бора его получение
в свободном состоянии производится
обычно методами металлотермии
(чаще всего восстановлением магнием
или натрием):
При этом выделяется аморфный бор, который перекристаллизацией в расплавленных металлах можно перевести в кристаллическое состояние. Однако этот метод дает продукт, загрязненный примесями, Более чистый бор (99,5%) получается электролизом расплавленных фтороборатов. Наиболее чистый бор получают термическим разложением паров бромида бора на раскаленной (1000—1200 °С) танталовой проволоке в присутствии водорода:
2 BBr3 + 3H2 = 2B + 6HBr
Или разложением (крекингом) его водородных соединений:
B2H6 = 2B + 3H2
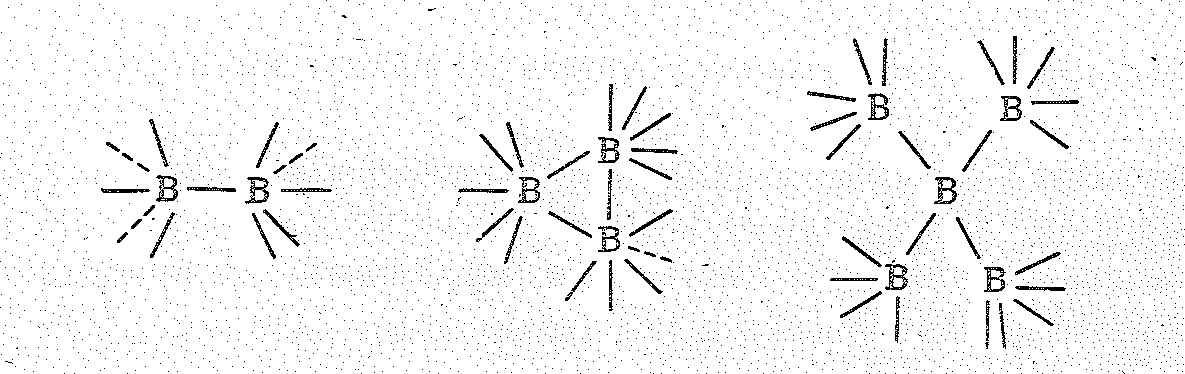
Металлические соединения бора. С металлами бор образует бориды среднего состава М4В, М2В, МВ, М3В4, МВ2, МВ6.
В зависимости от условий один и тот же элемент образует бориды разного состава, например Nb2В, Nb3В2, NВ, Nb3В4, NВ2, Сг4В, Сr2В, СrВ, Сr3В4, СгВ2. По мере увеличения содержания бора структура боридов существенно усложняется. В боридах типа М4В и М2В атомы бора изолированы друг от друга. В боридах типа М3В2 атомы бора связаны попарно, в МВ — в цепи, в М3В4— в сдвоенные цепи, в МВ2 — в сетки из шестичленных колец и, наконец, в боридах состава МВ6 и МВ12 — в трехмерные каркасы соответственно в виде октаэдрических и икосаэдрических группировок атомов.
Большинство боридов d- и f-элементов очень тверды, жаростойки (2000—3000 °С) и химически устойчивы. Бориды s-элементов химически активны, в частности, разлагаются под действием кислот, образуя смеси бороводородов.
Жаропрочные и жаростойкие бориды d-элементов (Сr, Zr, Тi, Nb , Та) и их сплавы применяются для изготовления деталей реактивных двигателей, лопаток газовых турбин и пр. Некоторые бориды используются как катализаторы, в качестве материалов для катодов электронных приборов и т. д.
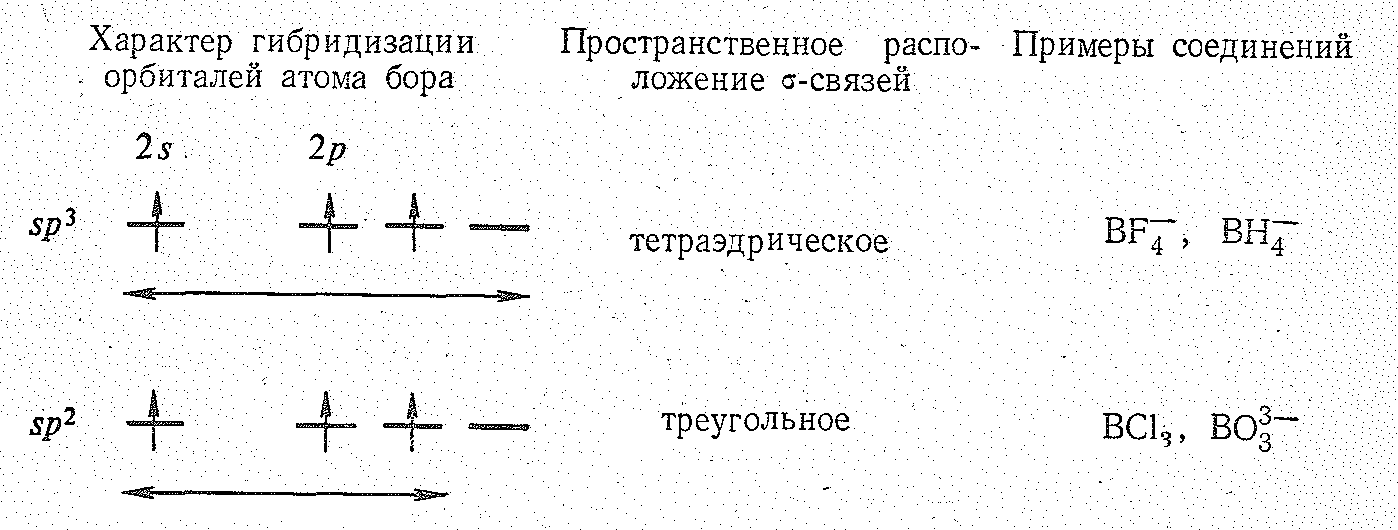
Соединения бора (III). Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными, чем он сам, элементами, т. е. в галогенидах, оксиде, сульфиде, нитриде, гидридах и в соответствующих анионных борат-комплексах, простейшие из которых приведены ниже:
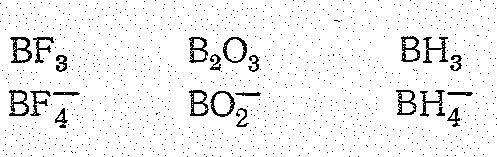
В зависимости от числа -связей координационное число бора (III) равно 4 или 3, что соответствует sр3- или sр2-гибридизации его валентных орбиталей.
s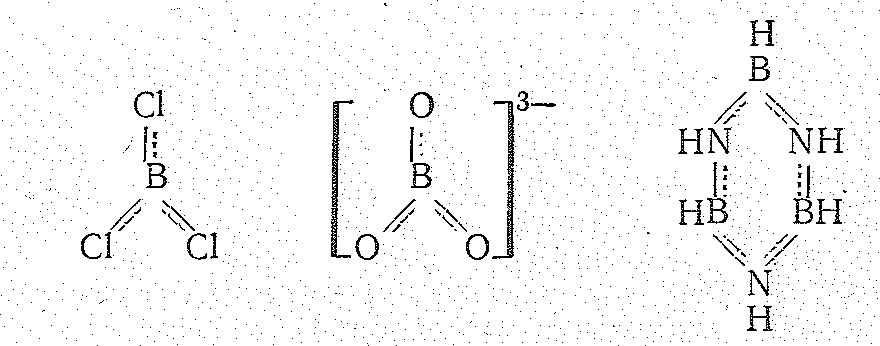 р2-Гибридизация
валентных орбиталей бора определяет
плоское треугольное строение молекул,
комплексов и. структурных единиц его
соединений. Как и в случае углерода,
sр2-гибридное
состояние стабилизируется за счет
нелокализованной р-р-связи.
Последняя образуется при участии
свободной 2р-орбитали
атома бора и неподеленной пары электронов
связанных с ним атомов:
р2-Гибридизация
валентных орбиталей бора определяет
плоское треугольное строение молекул,
комплексов и. структурных единиц его
соединений. Как и в случае углерода,
sр2-гибридное
состояние стабилизируется за счет
нелокализованной р-р-связи.
Последняя образуется при участии
свободной 2р-орбитали
атома бора и неподеленной пары электронов
связанных с ним атомов:
В результате возникает частичная двоесвязанность, упрочняется связь и уменьшается межъядерное расстояние.
Так, длина связи dBO при треугольном расположении (0,136 нм) на 0,012 нм короче, чем при тетраэдрическом (0,148 им). Аналогично длина связи dBF в ВF3 (0,129 нм) короче, чем в ВF4- (0,143 нм), а силовая постоянная связи BF в ВF3 больше (718 Н/м), чем в ВF4- (528 Н/м).
В соответствии с устойчивыми координационными числами бора (III) из бинарных соединений галогениды ВНаl3 мономолекулярны, а оксид В2О3, сульфид B2S3, нитрил ВN — полимерны.
Весьма своеобразна структура гидридов бора.
Бинарные соединения бора (III) кислотные. Об этом, в частности, свидетельствует характер их сольволиза (гидролиза) и взаимодействия с основными соединениями.
Галогениды типа ВНаl3 известны для всех галогенов. Могут быть получены из простых веществ при нагревании. Все они бесцветны. Молекулы ВНаl3 имеют форму плоского треугольника с атомом бора в центре (sр2-гибридное состояние бора). В обычных условиях ВF3 — газ, ВСl3 и ВВr3 — жидкости, ВI3 — твердое вещество.

В твердом состоянии галогениды имеют молекулярные решетки. В соответствии с увеличением длины связи и уменьшением ее энергии в ряду ВF3 — ВСl3 — ВВr3 — ВI3 устойчивость быстро уменьшается. Об этом свидетельствует также характер изменения энтальпии образования и энергии Гиббса образования. Наибольшее применение имеют ВF3 и ВСl3 . Трифторид получают нагреванием В2О3 с СaF2 в присутствии концентрированной Н2SO4 (похоже на получение SiF4).
В2О3 + 3СаF2 + 3Н2SO4 2ВF3 + 3СаSО4 + 3Н2O
Получение трихлорида бора (как и SiСl3 ) основано на хлорировании раскаленной смеси оксида и угля:
В2O3 + 3С + 3Сl2 = 2ВСl3 + 3СО
Тригалогениды бора — сильные акцепторы электронной пары; ВF3, например, присоединяет молекулу воды, аммиака, эфира, спирта и пр.
При взаимодействии с водой ВF3 дает ВF3Н2O (Tпл. 10,2 °С, Tразл. 20 °С). С аммиаком образует твердое вещество ВF3NН3 (Tпл. 163 °С).
|
|
ВF3NН3 вещество хорошо растворимое в воде без заметного гидролиза. В продуктах присоединения атомы бора находятся в состоянии sр3-гибридизации.
|
Способность к донорно-акцепторному взаимодействию определяет применение трифторида и трихлорида бора в органическом синтезе в качестве катализаторов.
Кислотная природа тригалогендов бора проявляется, например, при их гидролизе, который протекает необратимо с образованием кислот:
ВHаl3 + 3НОН = Н3ВО3 + 3ННаl
Вследствие этого ВСl3 и ВВr3 во влажном воздухе дымят, взаимодействие ВI3 с водой протекает со взрывом. Кислотный характер ВСl3 проявляет и при взаимодействии с жидким аммиаком:
ВСl3 + 6Н3N = В(NH2)3 + 3NH4Cl
Оксид бора (III) В2O3 существует в виде нескольких модификаций. В кристаллах В2O3 атомы бора находятся внутри равностороннего треугольника ВО3 либо тетраэдра ВО4 из атомов кислорода. Кристаллический В2O3 (плавится при 450 °С и кипит при 2250 °С) имеет высокие значения энтальпии (Но298 = —1461 кДж/моль) и энергии Гиббса образования (Go298 = —1178 кДж/моль). Он легко переходит в стеклообразное состояние и очень трудно кристаллизируется, Получают оксид В2О3 обезвоживанием Н3ВО3.
В отличие от цепи Si—О—Si цепь В—О—В относительно легко разрывается при гидратации; в этом отношении кислородные соединения бора (III) сходны с таковыми фосфора. Как кислотный оксид В2O3 энергично взаимодействует с водой с образованием борной кислоты Н3ВO3.
Сульфид бора В2S3 — стеклообразное вещество, водой полностью разлагается,
В соответствии с устойчивыми координационными числами бора 3 и 4 нитрид бора ВN существует в виде двух модификаций. При взаимодействии простых веществ образуется модификация с гексагональной атомно-слоистой структурой типа графита. Гексагональные кольца в нитриде бора содержат чередующиеся атомы В и N (на расстоянии 0,145 нм с углами 120o). Это соответствует sр2-гибридизации валентных орбиталей атомов бора и азота. (Расстояние между слоями в нитриде бора равно 0,334 им, т. е. короче, чем в графите — 0,340 им.) В отличие от графита ВN - белого цвета («белый графит») полупроводник (Е = 4,6—3,6 эВ), легко расслаивается на чешуйки, огнеупорен (Тпл. 3000 °С). Водой разлагается очень медленно при нагревании. Разложение усиливается при действии разбавленных кислот.
В другой модификации нитрида бора ВN (боразон или эльбор) атомы бора и азота находятся в состоянии sр3-гибридизации. Эта модификация имеет кристаллическую решетку типа алмаза. Она образуется из гексагональной при высоком давлении порядка 6—8 ГПа и нагревании (1800 °С). Превращение гексагонального нитрида бора в боразон аналогично превращению графита в алмаз.
Кристаллы боразона окрашены в цвета от желтого до черного или бесцветны. Боразон очень твердый и в этом отношении почти не уступает алмазу (некоторые образцы боразона даже царапают алмаз). К тому же в отличие от последнего он механически более прочен и термически более стоек. Например, при нагревании в вакууме до 2700 °С боразон совершенно не изменяется, при нагревании на воздухе до 2000 oС лишь слегка окисляется его поверхность, тогда как алмаз сгорает уже при 900 °С. Как и алмаз боразон — диэлектрик. Указанные свойства определяют все возрастающее значение боразона для техники.
Гидриды бора (бораны) по способу получения и по свойствам напоминают силаны. Обычно смесь боранов с водородом получается действием кислот на некоторые химически активные бориды, например:
6МgВ2 + 12НСl = Н2 + В4Н10 + 6МgСl2 + 8В
Простейшее водородное соединение бора BH3 в обычных условиях не существует. Это объясняется его координационной ненасыщенностью и невозможностью образования делокализованной -связи, которая стабилизировала бы sр2-гибридное состояние атома бора. Координационное насыщение атома бора возникает при сочетании этих молекул. радикалов друг с другом:
ВH3 (г) + ВН3 (г) = В2Н6 (г), Go298= — 127 кДж/моль.
Из выделенных в свободном состоянии гидридов бора состава ВnНn+4 и ВnНn+6 простейшими представителями являются: В2Н6, В4Н10 — газы, В5Н9, В6Н10, — жидкости, В10Н14 — твердое вещество.

Для всех боранов Gоf 0, поэтому их получают косвенным путем.
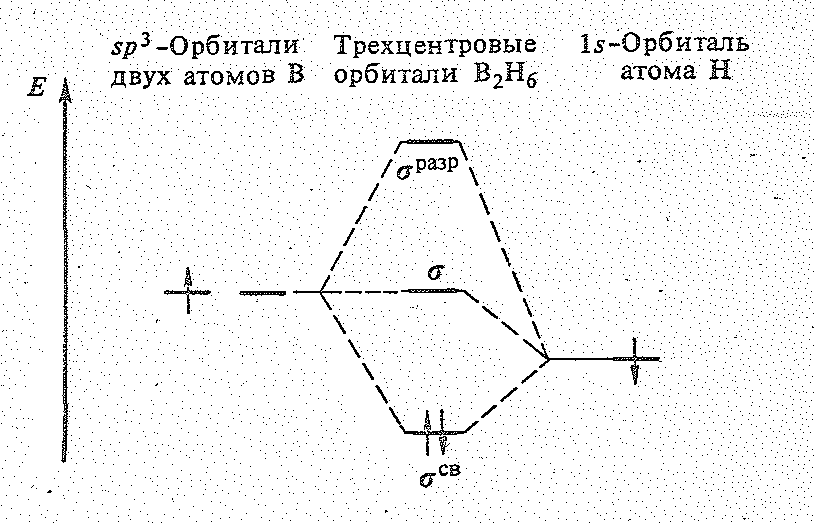
Как нетрудно видеть, бороводороды — соединения с дефицитом электронов. Например, в В2Н6 общее число валентных электронов равно 12; т. е. их не хватает для образования восьми обычных двухэлектронных двухцентровых связей. В диборане В2Н6 имеют место двух- и трехцентровые связи. Две концевые группы ВН2 лежат в одной плоскости, а атомы водорода и бора связаны
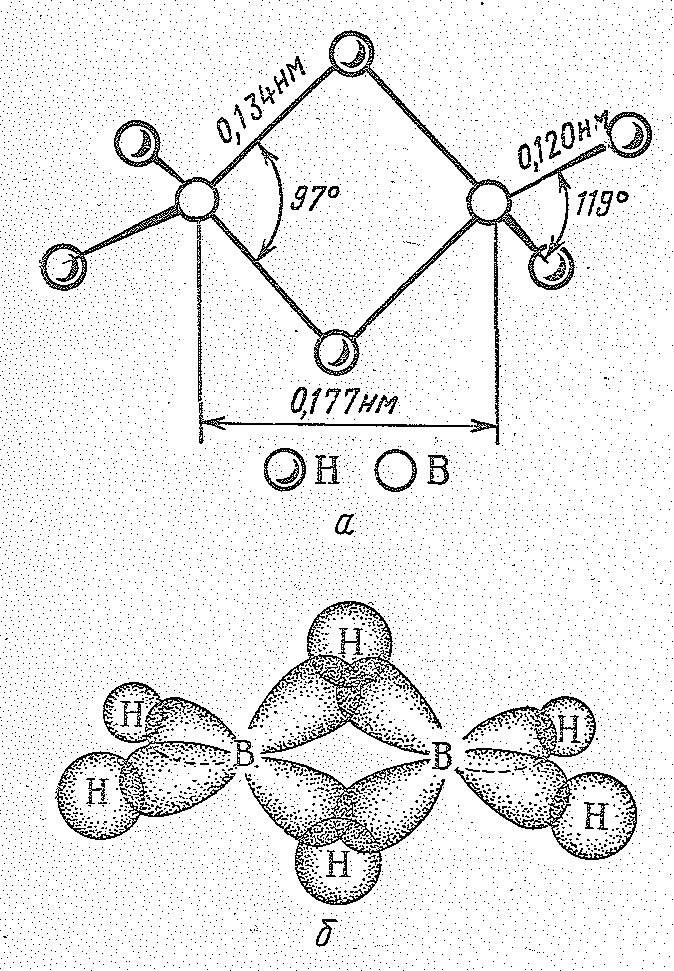
Рис. 1 Строение молекулы (а) и схема перекрывания атомных орбиталей (б) в молекуле В2Н6.