Подгруппа ванадия
Ванадий в земной коре более распространен, чем Сu, Zr, Рb, но его соединения редко встречаются в виде крупных месторождений. Ванадий рассеян в различных силикатных и сульфидных рудах. Наиболее важные его минералы патронит VS2–2,5, сульванит Сu3VS4, алаит V2O3Н2O, ванадинит Рb5(VO4)3Сl. Ниобий и тантал почти всегда встречаются совместно, чаще всего в составе ниобат-танталатовых минералов состава М+2Э2О6 (М = Fе, Мn). В слу чае преобладания тантала минерал М+2 (ТаО3)2 называется танталатом, при преобладании ниобия колумбитом М(NbО3)2 .
Простые вещества. В виде простых веществ V, Nb и Та серые тугоплавкие металлы с объемноцентрированной кубической рещеткой. Некоторые их константы приведены ниже:

Физико-химические свойства ванадия, ниобия и тантала существенно зависят от их чистоты. Например, чистые металлы ковки, тогда как примеси (особенно О, Н, N и С) сильно ухудшают пластичность и повышают твердость металлов.
В обычных условиях V и особенно Nb и Та отличаются высокой химической стойкостью. Ванадий на холоду растворяется лишь в царской водке и концентрированной НF, а при нагревании в – HNO3 и концентрированной Н2SO4. Ниобий и тантал растворяются лишь в плавиковой кислоте и смеси плавиковой и азотной кислот с образованием отвечающих их высшей степени окисления анионных фторокомплексов:
3Та0 + 5НNО3 + 2IНF = 3Н2[Та+5F7] + 5NO + 10Н2O
Ванадий, ниобий и тантал взаимодействуют также при сплавлении со щелочами в присутствии окислителей, т. е. в условиях, способствующих образованию отвечающих их высшей степени окисления анионных оксокомплексов:
4Э0 + 5О2 + 12КОН ===== 4К3[Э+5O4] + 6Н2O
cплавление
При нагревании металлы окисляются кислородом до Э2O5, фтором до ЭF5. При высокой температуре они реагируют также с хлором, азотом, углеродом и др.
Для получения ванадия, ниобия и тантала их природные соединения сначала переводят в оксиды либо в простые или комплексные галогениды, которые далее восстанавливают металлотермическим методом
Э2О5 + 5Са = 5СаО + 2Э
К2[ЭF7] + 5Nа = 2КF + 5NаF + Э
Тантал получают также электролизом Та2O5 в расплавленных комплексных фторидах К2[ТаF7].
Вследствие близости свойств ниобия и тантала их отделение друг от друга представляет значительные трудности. Особо чистые металлы получают термическим разложением иодидов. Для технических целей обычно выплавляют феррованадий, феррониобий и ферротантал.
Основной потребитель ванадия черная металлургия. Ценные физико-химические свойства V, Nb и Та позволяют использовать их при создании атомных реакторов. Ниобий и в еще большей степени тантал представляют интерес как конструкционные материалы для особо агрессивных сред в химической промышленности.
Соединения элементов подгруппы ванадия
Металлические и металлоподобные соединения. Порошкообразные V, Nb и Та адсорбируют значительные количества водорода, кислорода, азота, образуя твердые растворы внедрения. При этом неметаллы переходят в атомарное состояние и их электроны участвуют в построении d-зоны металлического кристалла. При нагревании растворимость неметаллов возрастает; вместе с тем изменяются характер химической связи и свойства образуемых соединений. Так, при образовании оксидов постепенное окисление ниобия (как и V и Та) кислородом протекает через следующие стадии:
Nb + О Nb—О Nb6O Nb2O NbO NbО2 Nb2О5
твердый раствор
По свойствам Nb6O и Nb2O типичные металлические соединения; NbO (серого цвета) — соединение переменного состава ( NbO0,94–1,04) с металлическим блеском и металлической проводимостью. Диоксид NbО2 (черного цвета) также переменного состава (NbО0,19-2,09), но уже полупроводник. И, наконец, Nb2О5 имеет более или менее постоянный состав и электронной проводимостью не обладает. Таким образом, по мере увеличения содержания кислорода постепенно уменьшается доля металлической связи и увеличивается доля ковалентной, что обусловливает изменение свойств оксидов.
Гидриды ванадий и его аналогов ЭН – хрупкие металлоподобные порошки серого или черного цвета, имеют переменный состав. Гидриды химически устойчивы, не взаимодействуют с водой и разбавленными кислотами.
Высокой коррозионной стойкостью обладают также нитриды (ЭN, Nb2N, Та2N), карбиды (ЭС, Э2С), бориды (ЭВ, ЭВ2, Э3В4), ряд других соединений ванадия и его аналогов с неактивными неметаллами.
Ванадий, ниобий и тантал между собой и с металлами, близко расположенными к ним в периодической системе (подгрупп железа, титана и хрома), образуют металлические твердые растворы. По мере увеличения различий в электронном строении взаимодействующих металлов возможность образования твердых растворов уменьшается и возрастает возможность образования интерметаллических соединений, например типа Со3V, Fе3V, Ni3V, Аl3V и др.
Интерметаллические соединения ванадия и его аналогов придают сплавам ценные физико-химические свойства. Так, ванадий резко повышает прочность, вязкость и износоустойчивость стали. Ниобий придает сталям повышенную коррозионную стойкость и жаропрочность. В связи с этим большая часть добываемого ванадия и ниобия используется в металлургии для изготовления инструментальной и конструкционной стали.
Большой интерес представляют сплавы на основе карбидов, нитридов, боридов и силицидов ниобия и тантала, отличающиеся исключительной твердостью, химической инертностью и жаростойкостью.
Соединения V (II), Nb (II), Та (II). Из производных, в которых элементы подгруппы ванадия проявляют степень окисления +2, относительно более устойчивы соединения ванадия. Координационное число ванадия (II) равно 6, что отвечает октаэдрическому строению его комплексов (структурных единиц) в соединениях.
Оксид ванадия (П) VО (УО0,9—VО1,3) имеет кристаллическую решетку типа NаСl. Он черного цвета, обладает металлическим блеском и сравнительно высокой электрической проводимостью. Получают VО восстановлением V2O5, в токе водорода. С водой VО не взаимодействует, но как основное соединение довольно легко реагирует с разбавленными кислотами:
VО + 2ОН3+ + 3Н2O = [V(OH2)6]2+
Ион [V(ОH2)6]2+ фиолетового цвета. Такую же окраску имеют кристаллогидраты, например М+12SO4VSO46Н2O, VSO47Н2O, VСl26Н2O.
Соединения V (II) — сильные восстановители. Фиолетовые растворы производных [V(OH2)6]2+ довольно легко окисляются до [V(ОH2)6]3+ и их окраска становится зеленой. В отсутствие окислителей (например, кислорода воздуха) растворы соединений V(II) постепенно разлагают даже воду с выделением водорода.
Производные Nb (II) и Та (II) относятся к соединениям кластерного типа.
Соединения V (III), Nb (III), Та(III). Координационное число ванадия (III) равно 6. По структуре соединения V (III) аналогичны однотипным производвым Аl (IП). Черный оксид ванадия (III) V2О3 имеет кристаллическую решетку типа корунда -А12O3; состав его переменный VО1,60—1,80. Из щелочных растворов соединений V (III) выделяется зеленый гидроксид V(ОН)3 переменного состава V2ОnН2О. Эти соединения амфотерны, но с преобладанием основных свойств. Так, V2O3 и V2О3nН2О растворяются в кислотах:
V2O3 + 6ОН3+ + 3Н2O = 2[V(OH2)6]3+
Образующиеся аквокомплексы [V(OН2)6]3+ и производимые от них кристаллогидраты VСl36Н2O, VI3 6Н2О имеют зеленую окраску. Фиолетовую окраску имеют ванадиевые квасцы М+1[V(SО4)2]12Н2O, которые при растворении дают зеленые растворы.
Тригалогениды ванадия VНаl3 — кристаллические вещества. Трихлорид VСl3 имеет слоистую структуру. С соответствующими основными галогенидами VНаl3 образуют галогенидованадаты — производные ионов [VНаl6]3- и [V2Сl9]3—:
3KF + VF3 = К3[VF6]; ЭКСl + 2VСl3 = К3[V2Сl9]
Производные ванадия (III) — сильные восстановители, в растворах они довольно легко окисляются кислородом воздуха до производных V (IV). Тригалогениды при нагревании диспропорционируют:
2VСl3 (т) = VСl2 (т) + VСl4 (г)
Эта реакция эндотермична, и ее протекание обязано энтропийному фактору (за счет образования летучего VСl4).
Производные Nb (ПI) и Та (III) в основном относятся к соединениям кластерного типа.
Соединения V (IV), Nb (IV), Та (IV). При обычных условиях степень окисления +4 для ванадия наиболее характерна. Соединения V (III) довольно легко окисляются до производных V (IV) молекулярным кислородом, а соединения V (V) восстанавливаются до производных V (IV). Наиболее устойчивое координационное число ванадия (IV) равно 6, а также устойчивы координационные числа 4 и 5.
Из производных V (IV) известны синий VO2 (VO1,8-2,17), коричневый VF4 и красно-бурая жидкость VСl4, а также оксогалогениды типа VОНаl2. Диоксид VО образуется при осторожном восстановлении V2O5 водородом, а VСl4 при окислении ванадия (или феррованадия) хлором или взаимодействием раскаленного V2O5 с ССl4.
Диоксид имеет кристаллическую решетку типа рутила ТiО2. Молекула VСl4, как и ТiСl4, имеет тетраэдрическую форму.
По сравнению с однотипными производными V (II) и V (IП) бинарные соединения V (IV) кислотные свойства проявляют более отчетливо. Так, нерастворимый в воде VO2 относительно легко взаимодействует при нагревании со щелочами. При этом образуются оксованадаты (IV) бурого цвета, чаще всего состава M2[V4O9]:
4VO2 + 2КОН = К2[V4О9] + Н2О
Еще легче VО2 растворяется в кислотах. При этом образуются не простые аквокомплексы V4+, а аквопроизводные оксованадила VO2+, характеризующиеся светло-синей окраской: VО2 + 2Н+ + 4Н2О = [VО(ОН2)5]2+
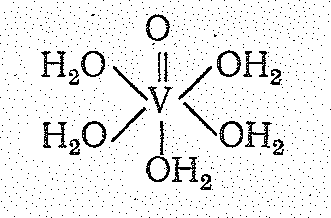 Оксованадильная
группировка VО2+
отличается высокой устойчивостью, так
как связь VО
близка к двойной:
Оксованадильная
группировка VО2+
отличается высокой устойчивостью, так
как связь VО
близка к двойной:
Межатомное расстояние dVO в ванадильной группировке составляет 0,167 ни, тогда как расстояние dV-OH2 = 0,23 им.
Группировка VO2+ остается неизменной в ходе различных реакций; в зависимости от природы лигандов она может входить в состав как катионных или анионных комплексов, так и нейтральных молекул.
Взаимодействие VНаl4 с основными галогенидами не характерно, но для V (IV) весьма типичны производные анионных комплексов оксованадила типа К2[VOF4], (NН4)3[VОF5].
Тетрагалогениды ванадия легко гидролизуются. Так, в воде VСl4 мгновенно переходит в VOСl2 (дихлорид ванадила):
VCl4 + H2O = VOСl2 + 2НСl
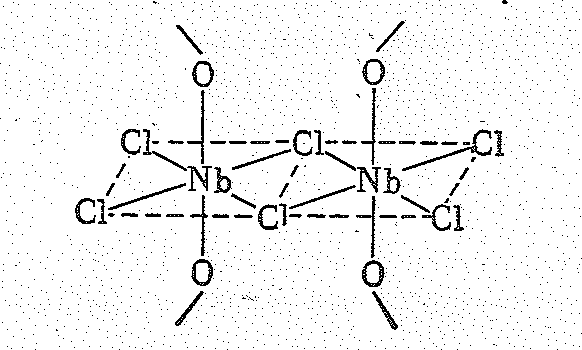
Для ниобия и тантала известны диоксиды ЭО2, тетрагалогениды ЭНаl4, оксодигалогениды ЭОНаl2. Полагают, что в этих соединениях проявляется связь металл — металл, т. е. они относятся к кластерам.
Характерная для ниобия и тантала тенденция к использованию при образовании химической связи всех своих валентных электронов обычно осуществляется за счет перехода их в высшую степень окисления +5. При низких же степенях окисления эта тенденция осуществляется за счет образования связей М—M.
Соединения V (V), Nb (V), Та (V). В ряду V (V) — Nb (V) — Та (V) устойчивость соединений возрастает. Об этом, в частности, свидетельствует сопоставление энергий Гиббса образования однотипных соединений, например:

Для ванадия (V) известны лишь оксид V2O5 и фторид VF5, тогда как для ниобия (V) и тантала (V) известны и все другие галогениды ЭНаl5, для Э (V), кроме того, характерны оксогалогениды типа ЭОНаl3. Все указанные соединения типично кислотные. Некоторые отвечающие им анионные комплексы приведены ниже:
Д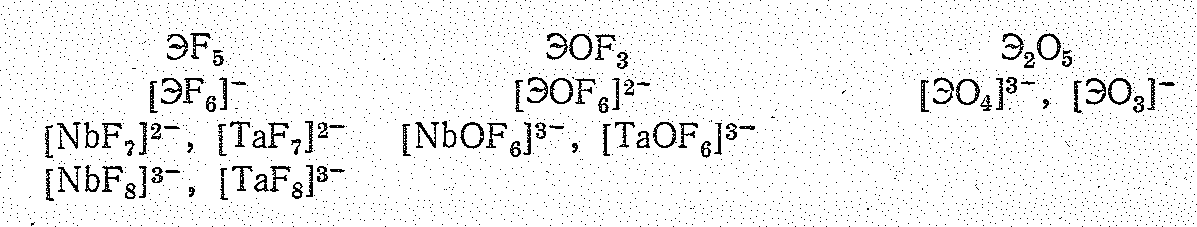 ля
V
(V)
наиболее типичны координационные числа
4 и 6, а для Nb
(V)
и Та (V)
6 и 7. Кроме того, существуют соединения,
в которых координационное число Nb
(V)
и Та (V)
достигает 8.
ля
V
(V)
наиболее типичны координационные числа
4 и 6, а для Nb
(V)
и Та (V)
6 и 7. Кроме того, существуют соединения,
в которых координационное число Nb
(V)
и Та (V)
достигает 8.
Оксиды красный V2O5 (Tпл. 670 °С), белые Nb2O5 (Tпл. 1490 °С) и Та2О5 (Tпл. 1870 °С) — тугоплавкие кристаллические вещества. Структурная единица Э2O5 — октаэдр ЭO6. (В случае V2О5 октаэдр VO6 очень сильно искажен - почти тригональная бипирамида с одним добавочным удаленным атомом кислорода.) Оксиды имеют высокие теплоты и энергии Гиббса образования. При этом вследствие лантаноидного сжатия значения Н0f и Gof для Nb2O5 и Та2O5 близки и заметно отличаются от таковых для V2O5.
Оксид ванадия (V) получают термическим разложением NН4VО3:
NН4VО3 = V2O5 + 2Н3N + Н2O
Он весьма плохо растворим в воде (~0,007 г/л при 25°С), образует кислый раствор светло-желтого цвета; довольно легко растворяется в щелочах, а в кислотах — лишь при длительном нагревании. Оксиды Nb (V) и Та (V) химически неактивны, в воде и кислотах практически не растворяются, а со щелочами реагируют лишь при сплавлении:
Э2О5 + 2КОН = 2КЭO5 + Н2О
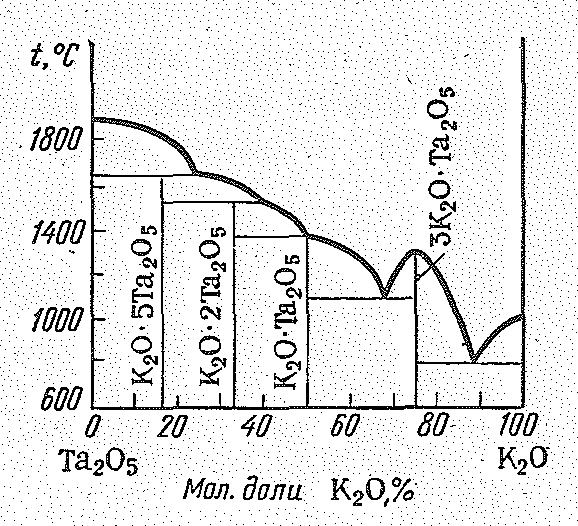
Оксованадаты (V), оксониобаты (V) и оксотанталаты (V) — кристаллические сложного состава и строения. О их многообразии и сложности состава можно судить по характеру соответствующих диаграмм плавкости (например, рис. 2). Простейшие по составу соединения типа М+1ЭО3 и М+13ЭO4. В большинстве своем оксованадаты (V) и, в особенности, оксониобаты (V) и оксотанталатьт (V) — полимерные соединения.
|
Рис. 2. Диаграмма плавкости системы Ta2O5 – K2O.
Так, NаNbО3 кристаллизуется по типу перовскита, а Fе(NbО3)2, Мn(ТаO3)2 являются смешанными оксидами со структурой типа рутила. В воде растворимы лишь производные s-элементов I группы и NH4+. Из ванадатов наибольшее значение имеет NН4VО3 — исходное вещество для получения других соединений ванадия. |
Кислоты, действуя на растворы оксованадатов, вызывают полимеризацию ванадат-ионов вплоть до образования осадка гидратированного оксида V2O5nН2О. Изменение состава ванадат-ионов сопровождается изменением окраски от почти бесцветного VО43- до оранжевого V2O5nН2О.
Пентагалиды ЭНаl5 имеют островную структуру, поэтому они легкоплавки, летучи, растворяются в органических растворителях, химически активны. Фториды бесцветны, остальные галогениды окрашены.
Кристаллы NbF5 (Tпл. 80 °С, Tкип. 235 °С) и ТаF5 (Tпл. 95 °С, Tкип. 229 °С) состоят из тетрамерных молекул (ЭF5)4, а ЭСl5 и ЭВr5 (Tпл. и Tкип. порядка 200—300 °С) — из димерных молекул (ЭНаl5)2:
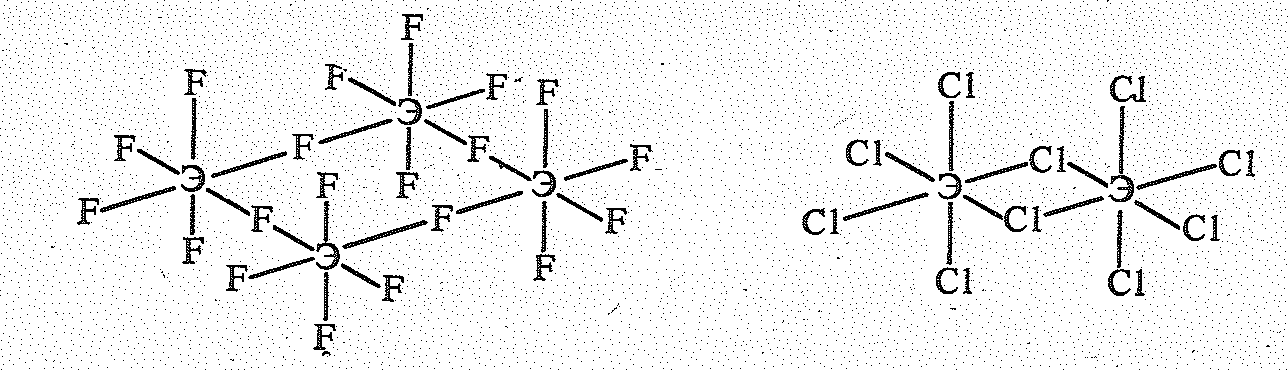
VF5— вязкая жидкость (Tпл. 19,5 °С), по строению подобен SbF5. Будучи кислотными соединениями, пентагалогениды легко гидролизуются, образуя аморфные осадки гидратированных оксидов:
2ЭНаl5 + 5Н2O = Э2O5 + 10HHal
Пентафториды, а также пентахлориды Nb и Та, кроме того, реагируют с соответствующими основными галогенидами с образованием анионных комплексов [ЭF6]-, а в случае Nb (V) и Та (V), кроме того, [ЭF7]2-, [ЭF8]3- и [ЭСl6]-, например:
КF + VF5 = К[VF6]
2КF + ТаF5 = К2[ТаF7]
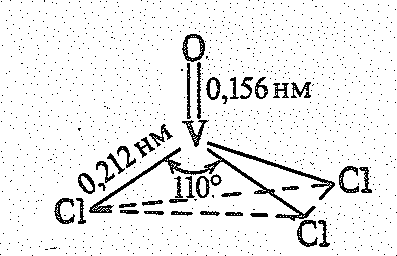
Оксогалогениды ЭОНаl3 обычно твердые вещества, в большинстве летучие, а VОСl3 – жидкость (Tпл. — 77 oС, Tкип. 127 oС).
Молекула VОСl3 имеет форму искаженного тетраэдра с атомом ванадия в центре:
|
|
В решетке NbOСl3 димерные группы Nb2Сl6 соединены через мостики Nb—О—Nb, образуя бесконечные цепи из октаэдров NbO2Сl4.
Оксогалогениды легко гидролизуются с образованием гидратированных оксидов Э2О5nН2О и ННаl
2ЭОНаl3 + 3Н2O = Э2O5 + 6ННаl
и вступают во взаимодействие с основными галогенидами с образованием анионных комплексов состава [VОF5]2-, а для NB (V) и Та (V), кроме того, [ЭОСl4]-, [ЭОНаl5I2-, [ЭOF6]3- (Наl = F, Сl), например:
2КF + VOF3 = К2[VОF5]
3КF + NbОF3 = К3[NbОF6]
При взаимодействии с водными растворами, содержащими КF и НF, Nb2O5 дает К2[NbOF5], а Та2O5 образует К2[ТаF7]:
Nb2O5 + 4КF + 6НF = 2К2[NbOF5] + 3Н2O
Та2O5 + 4КF + 10НF = 2К2[ТаF7] + 5Н2O
На различии в растворимости К2[ТаF7] и К2[NbОF5] основан один из методов разделения ниобия и тантала.
Для ванадия (V) и его аналогов весьма характерны пероксокомплексы типа желтого [VО2(О2)2]3-, сине-фиолетового [V(О2)4]3- и бесцветных [Nb(О2)4]3- и [Та(О2)4]3-. По строению [Э(O2)4]3- представляют собой додекаэдр.
Пероксованадаты, пероксониобаты и пероксотанталаты образуются при действии пероксида водорода и соответствующие соединения Э (М) в щелочной среде. Например:
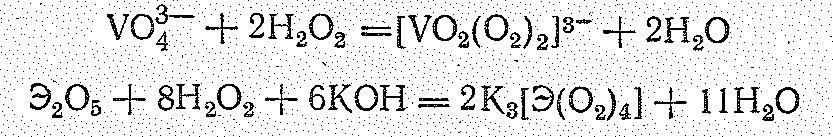
В твердом состоянии эти соединения устойчивы, При действии кислот пероксованадаты разлагаются, а пероксониобаты и пероксотанталаты переходят в соответствующие пероксокислоты состава НЭО4.
П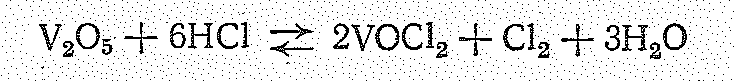 роизводные
ванадия (V)
в кислой среде проявляют окислительные
свойства, например окисляют концентрированную
соляную кислоту:
роизводные
ванадия (V)
в кислой среде проявляют окислительные
свойства, например окисляют концентрированную
соляную кислоту:
Для перевода же ниобия (V) и в особенности тантала (V) в более низкие степени окисления требуются энергичные восстановители и нагревание.
Соединения ванадия используются в химической промышленности в качестве катализаторов (производство серной кислоты), а также применяются в стекольной и других отраслях промышленности.