
Т 11 Л 16 Общая характеристика d и f –элементов
Химические элементы по структуре невозбужденных атомов подразделяются на естественные совокупности, что отражено в периодической системе в виде горизонтальных и вертикальных рядов - периодов и групп.
Элементы, в атомах которых заполняются s-орбитали, называются s-элементами, элементы, в атомах которых заполняются p-орбитали, p-элементами, d-орбитали, d-элементами, f –орбитали, f-элементами.
Первый период содержит только s-элементы, второй период s-элементы и p-элементы, третий период также содержит s- и p-элементы. В отличие от второго периода в 3-м периоде во внешнем слое свободными остаются 3d-орбитали.
Элементы больших периодов. Периоды 4-й и 5-й содержат по 18 элементов. У атомов элементов 4-го периода начинает заполняться 4s-орбиталь слоя N (n = 4). Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловливается экранированием (заслонением) ядра плотным и симметричным электронным слоем 3s23р6. В связи с отталкиванием от этого слоя для 19-го электрона атома калия и 20-го электрона атома кальция оказывается энергетически выгодным 4s-состояние:
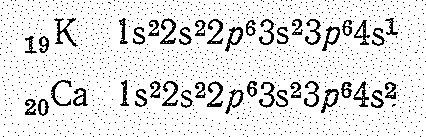
При дальнейшем возрастании эффективного заряда ядра у следующего после кальция элемента — скандия состояние 3d становится энергетически более выгодным, чем 4р.
Х арактер
заполнения орбиталей атомов К, Са, и Sс
показывает, что энергия электронов
зависит не только от заряда ядра, но и
от взаимодействия между электронами.
На рис. 1 показана зависимость энергии
атомных орбиталей от порядкового номера
элемента (логарифмическая шкала). За
единицу энергии электрона принято
значение 13,6 эВ (энергия электрона
невозбужденного атома водорода). Анализ
рис. 1 показывает, что с увеличением
порядкового номера элемента энергия
электронов данного состояния (1s,
2s,
2р
и т. д.) уменьшается. Однако характер
этого уменьшения для электронов разных
энергетических состояний различен, что
выражается в пересечении хода кривых.
В частности, поэтому при Z
= 19 и 20 кривые энергии 4s-электрона
лежат ниже кривой энергии 3d-электрона,
а при = 21 кривая энергии 3d-электрона
лежит ниже кривой 4р-электрона.
Таким образом, у калия и кальция
заполняется 4s-орбиталь,
а у скандия 3d-орбиталь.
арактер
заполнения орбиталей атомов К, Са, и Sс
показывает, что энергия электронов
зависит не только от заряда ядра, но и
от взаимодействия между электронами.
На рис. 1 показана зависимость энергии
атомных орбиталей от порядкового номера
элемента (логарифмическая шкала). За
единицу энергии электрона принято
значение 13,6 эВ (энергия электрона
невозбужденного атома водорода). Анализ
рис. 1 показывает, что с увеличением
порядкового номера элемента энергия
электронов данного состояния (1s,
2s,
2р
и т. д.) уменьшается. Однако характер
этого уменьшения для электронов разных
энергетических состояний различен, что
выражается в пересечении хода кривых.
В частности, поэтому при Z
= 19 и 20 кривые энергии 4s-электрона
лежат ниже кривой энергии 3d-электрона,
а при = 21 кривая энергии 3d-электрона
лежит ниже кривой 4р-электрона.
Таким образом, у калия и кальция
заполняется 4s-орбиталь,
а у скандия 3d-орбиталь.
Поскольку в d-состоянии может находиться десять электронов, 3d-орбитали заполняются и в атомах последующих элементов:
Элементы, в атомах которых заполняются d-орбитали, называются d-элементами. У d-элементов 4-го периода, следовательно, достраивается слой М до 18 электронов.
После заполнения 3d-орбиталей у последующих шести элементов (Gа—Кr) заполняются р-орбитали внешнего слоя. Таким образом, 4-й период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от 2-го и 3-го периодов между s- и р-элементами располагаются десять d-элементов.
В 5-м периоде заполнение электронных слоев и подслоев происходит, как и в 4-м периоде, а именно: у двух первых (s-элементов Rb и Sr) и шести последних (р-элементов In—Хе) заполняется внешний слой. Между s- и р-элементами располагаются десять d-эрементов (Y—Сd), у которых заполняются d-орбитали предвнешнего слоя (4d- подслой).
|
Рис. 1. Изменение уровней энергии в зависимости от порядкового номера элементов. |
Шестой период содержит 32 элемента и тоже начинается двумя s-элементами (Сs и Ва). Далее, у лантана начинает заполняться d-орбиталь предвнешнего слоя (5d-подслой):

У следующих за лантаном 14 элементов (Се—Lu) вследствие роста эффективного заряда ядра 4f-состояние энергетически более выгодное, чем 5d-состояние (рис. 1). Поэтому у этих элементов происходит заполнение 4f-орбитали (второй снаружи квантовый слой). Затем продолжается заполнение 5d-орбитали (Нf—Нg). И этот период завершается шестью р-элементами (Тl—Rn), Таким образом, в 6-м периоде кроме двух s-элементов, десяти d-элементов и шести р-элементов располагаются еще четырнадцать f-элементов.
В седьмом периоде имеются два s-элемента (Fr, Rа), за ними следуют d-элемент Ас и четырнадцать f-элементов (Тh—Lr), далее снова d-элементы (Rf-резерфордий, Db-дубний,Sg-сиборгий, Bh-борий, Hs-хассий, Mt-мейтнерий). 7-й период не завершен.
По мере роста заряда ядра происходит закономерная периодическая повторяемость сходных электронных структур, а следовательно, и повторяемость свойств элементов.
В настоящее время периодический закон формулируется следующим образом: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов.
Но еще более точно будет сказать – сущность периодичности заключается в существовании предельной емкости электронных слоев и периодическом воспроизведении сходных валентных конфигураций на все более высоком энергетическом уровне (в результате наложения квантово-химического принципа Паули на классический принцип наименьшей энергии в атомной системе).
Как мы видели, период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных слоев. При этом номер периода совпадает со значением главного квантового числа n внешнего энергетического уровня. Различие в последовательности заполнения электронных слоев (внешних и более близких к ядру) объясняет причину различной длины периодов.
Как мы видели, у s- и р-элементов заполняется внешний слой, у d-элементов — предвнешний, у f-элементов — третий снаружи. Поэтому отличия в свойствах наиболее отчетливо проявляются у соседних s-(р-)элементов. У d- и в особенности у f-элементов одного и того же периода отличия в свойствах проявляются менее отчетливо.
d- и f-Элементы данного периода объединяются в семейства. В 4— 6-м периодах в семейства по 10 элементов объединяются d-элементы. Это — семейства 3d-(Sс—Zn), 4d- (Y—Сd) и 5d- (Lа, Нf—Нg) элементов. В 6-м и 7-м периодах в семейства по 14 элементов объединяются f-элементы. Это — семейства 4f-элементов (Се—Lu), называемых лантаноидами, и семейство 5f-элементов (Тh—Lr), называемых актиноидами.
Изменение атомных, и ионных радиусов в периодической системе имеет периодический характер. В периодах атомные и ионные радиусы по мере увеличения заряда ядра в общем уменьшаются. Наибольшее уменьшение радиусов наблюдается у элементов, малых периодов, так как у них происходит заполнение внешнего электронного слоя. В больших же периодах в пределах семейств d- и f-элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называется соответственно d и f-сжатием. В подгруппах элементов радиусы атомов однотипных ионов в общем увеличиваются. Однако увеличение радиусов при том же возрастании заряда ядра в подгруппах s- и p-элементов больше такового в подгруппах d-элементов.
Существенно подчеркнуть еще одну особенность для подгрупп d-элементов. Увеличение атомных и ионных радиусов в подгруппах d-элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы d-элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f-сжатием1, вызванным заполнением 4f-подслоя у f-элементов 6-го периода. При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов и ионов для d-элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Все сказанное аналогично относится и к 7 периоду.
d-Элементы называют также переходными. Они расположены в периодической системе в больших периодах между s и р-элементами. Характерной особенностью переходных элементов является то, что в их атомах заполняются орбитали не внешнего слоя (как у s- и р-элементов), а предвнешнего (d-элементы) слоя. У d-элементов валентными являются энергетически близкие девять орбиталей — одна ns-орбиталь, три nр-орбитали и пять (n — 1)d-орбиталей:

На внешнем слое у d-элементов находятся 1—2 электрона (ns-состояние), остальные валентные электроны расположены в (n—1) d-состоянии предвнешнего слоя. Подобное строение электронных оболочек атомов d-элементов определяет ряд их общих свойств. Простые вещества, образованные переходными элементами, являются металлами (число валентных электронов в их атомах заметно меньше числа орбиталей).
За немногим исключением, d-элементы проявляют переменную степень окисления. Почти для всех d-элементов, в частности, возможна степень окисления +2 — по числу внешних электронов. Высшая степень окисления большинства d-элементов отвечает номеру группы периодической системы, в которой они находятся. В отличие от подгрупп s- и р-элементов в подгруппах d-элементов с увеличением порядкового номера элемента значение устойчивой степени окисления возрастает.
В следствие
разнообразия степеней окисления для
химии d-элементов
очень характерны окислительно-восстановительные
реакции. По этой же причине почти каждый
из d-элементов
имеет соединения, резко отличающиеся
по своим кислотно-основным свойствам,
например:
следствие
разнообразия степеней окисления для
химии d-элементов
очень характерны окислительно-восстановительные
реакции. По этой же причине почти каждый
из d-элементов
имеет соединения, резко отличающиеся
по своим кислотно-основным свойствам,
например:
Гидроксиды ЭОm(ОН)n (m¹0) обладают кислотными свойствами. Что объясняется тем, что атомы кислорода, ковалентно связанные с элементом, способствуют поляризации связи О–Н, в силу чего облегчается диссоциация с отщеплением протона.
Значительная часть соединений переходных элементов относится к числу координационных. Среди последних весьма разнообразны комплексные соединения d-элементов. Напомним, что для координационных соединений характерно то, что в структуре их кристаллических решеток нет отдельных молекул данного соединения (например, NаСl, СоО, К4[Fе(СN)6]): Каждый атом (ион) в таких соединениях окружен некоторым числом лигандов (атомы, ионы или группировки атомов). Если подобные комплексы (центральный атом и окружающие его лиганды) при переходе соединения в раствор не разрушаются, то такие координационные соединения относят к комплексным. Сопоставим структуры двух координационных соединений: СоО (структурный тип NаСl) и [Ni(NН3)6]Сl2. Очевидно, что последнее соединение является комплексным, а СоО к комплексным соединениям не относится.
Для объяснения образования и свойств комплексных соединений в настоящее время применяются метод валентных связей (МВС), теория кристаллического поля (ТКП) и метод молекулярных орбиталей (ММО).
f-Элементы 5-го и 6-го периодов периодической системы
f-Элементы (как и d-элементы) относят к переходным элементам. Они расположены в 6-м (4f-элементы) и 7-м (5f-элементы) периодах периодической системы. 4f-Элементы объединяют в семейство лантаноидов, а 5f-элементы — в семейство актиноидов. f-Элементы обычно помещают в III группу — в подгруппу скандия.
Семейство лантаноидов
К лантаноидам относятся: церий Се, празеодим Рг, неодим Nd, прометий Рm, самарий Sm, европий Еu, гадолиний Gd, тербий Тb. диспрозий Dу, гольмий Но, эрбий Еr, Тулий Тm, иттербий Уb и лютеций Lu.
Электронная конфигурация атомов лантаноидов может быть выражена общей формулой 4f2-145s25р65d0-16s2. У них достраивается третий снаружи слой (4f-подслой) при одинаковом числе электронов наружного (6s2) и у большинства лантаноидов преднаружного (5s25р6) слоя. Согласно химическим и спектроскопическим данным при большой энергетической близости 4f- й 5d-состояний для лантаноидов 4f-состояние оказывается все же энергетически более выгодным. Поэтому в их атомах (кроме Gd) 5d-электрон в отличие от Lа переходит в 4f-состояние.
По характеру заполнения 4f-орбиталей элементы семейства лантаноидов разделяются на подсемейства. Первые семь элементов Се—Gd), у которых в соответствии с правилом Хунда 4f-орбитали заполняются то одному электрону, объединяются в подсемейство церия; семь остальных элементов (Тb—Lu), у которых происходит заполнение 4f-орбиталей по второму электрону, объединяются в подсемейство тербия:
Д ополнительный
электрон (сверх устойчивой конфигурации
f7
и f14)
у Gd
и Lu,
как и у лантана, находится в 5d-состоянии.
ополнительный
электрон (сверх устойчивой конфигурации
f7
и f14)
у Gd
и Lu,
как и у лантана, находится в 5d-состоянии.
При незначительном возбуждении один из 4f-электронов (реже два) переходит в 5d-состояние. Остальные же 4f-электроны, экранированные от внешнего воздействия 5s25р6-электронами, на химические свойства большинства лантаноидов существенного влияния не оказывают. Таким образом, свойства лантаноидов в основном определяют 5d16s2-электроны. Поэтому лантаноиды проявляют большое сходство с d-элементами III группы — скандием и его аналогами. Наибольшее сходство с лантаноидами проявляют иттрий и лантан, атомные и ионные радиусы которых близки к таковым у элементов семейства.
Поскольку отличие в структуре атомов элементов семейства проявляется лишь в третьем снаружи слое, мало влияющем на химические свойства элементов, лантаноиды очень сходны друг с другом. Благодаря особой близости свойств часто лантаноиды совместно с лантаном; иттрием, а также скандием объединяют в одно семейство — семейство редкоземельных элементов РЭЭ.
При исключительной близости свойства лантаноидов, однако, все же отличаются; при этом некоторые их свойства в ряду Се—Lu изменяются монотонно, другие — периодически. Монотонное изменение свойств объясняется лантаноидным сжатием — постепенным уменьшением в ряду Се—Lu атомных и ионных радиусов.
Периодический характер заполнения 4f-орбиталей сначала по одному, а затем по два электрона предопределяет внутреннюю периодичность в изменении свойств лантаноидов и соединений.
Поскольку у лантаноидов валентными в основном являются 5d16s2-электроны, их устойчивая степень окисления равна +3. Однако элементы, примыкающие к лантану (4f0), гадолинию (4f7) и лютецию (4f14) имеют переменные степени окисления. Так, для церия (4f26s2) наряду со степенью окисления +3 характерна степень окисления +4. Это связано с переходом двух 4f-электронов в 5d-состояние. По той же причине степень окисления +4 может проявлять и празеодим (4f36s2) (хотя она и значительно менее характерна, чем для Се). Европий, имеющий семь 4f-электронов (4f76s2), может, напротив, проявлять степень окисления +2.
Аналогичное соотношение имеет место и для элементов подсемейства тербия. (Правда, вследствие спаривания 4f-электронов оно выражено менее отчетливо). Тербий (4f96s2) и диспрозий (4f106s2) могут проявлять степень окисления +4, а иттербий (4f146s2) и тулий (4f136s2) + 2. Периодический характер изменения степеней окисления виден из следующего сопоставления:
Р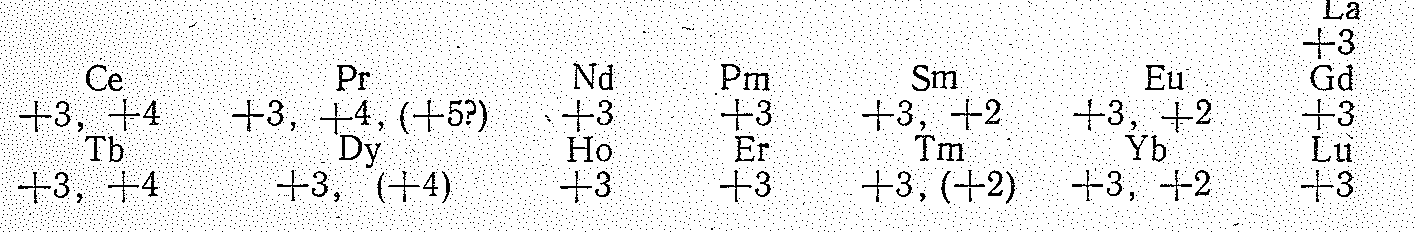 азличия
в свойствах элементов семейства,
связанные с лантаноидным сжатием и
характером заполнения 4f-орбиталей,
конечно, невелики. Однако на общем фоне
поразительно большого сходства эти
различия имеют важное значение, в
частности, для отделения лантаноидов
друг от друга.
азличия
в свойствах элементов семейства,
связанные с лантаноидным сжатием и
характером заполнения 4f-орбиталей,
конечно, невелики. Однако на общем фоне
поразительно большого сходства эти
различия имеют важное значение, в
частности, для отделения лантаноидов
друг от друга.
По содержанию в земной коре лантаноиды не уступают таким элементам, как иод, сурьма, медь. Но они очень рассеяны в природе.
Известно, например, более 250 минералов, содержащих лантаноиды. Лантаноиды с четными порядковыми номерами более распространены, чем с нечетными.
Лантаноиды с нечетными номерами имеют лишь по одному природному изотопу (за исключением европия и лютеция, имеющих по два изотопа). Лантаноиды с четными номерами имеют по семь изотопов (кроме эрбия и церия, имеющих соответственно шесть и четыре природных изотопа). Для всех РЗЭ получены искусственные радиоактивные изотопы, образующиеся, в частности, в ядерных реакторах.
Элементы семейства встречаются в природе всегда вместе друг с другом, а также с лантаном и иттрием. Наиболее важными минералами для извлечения РЗЭ являются моноцит ЭРО4, бастнезит ЭFСО3, лопарит (Та,Са,Э)2(Тi,Nb,Та)2О6 и т.д.
Прометий радиоактивный элемент, в земной коре практически не встречается. Он был обнаружен в 1947 г. в продуктах деления ядер урана в атомных реакторах; его получают искусственным путем.
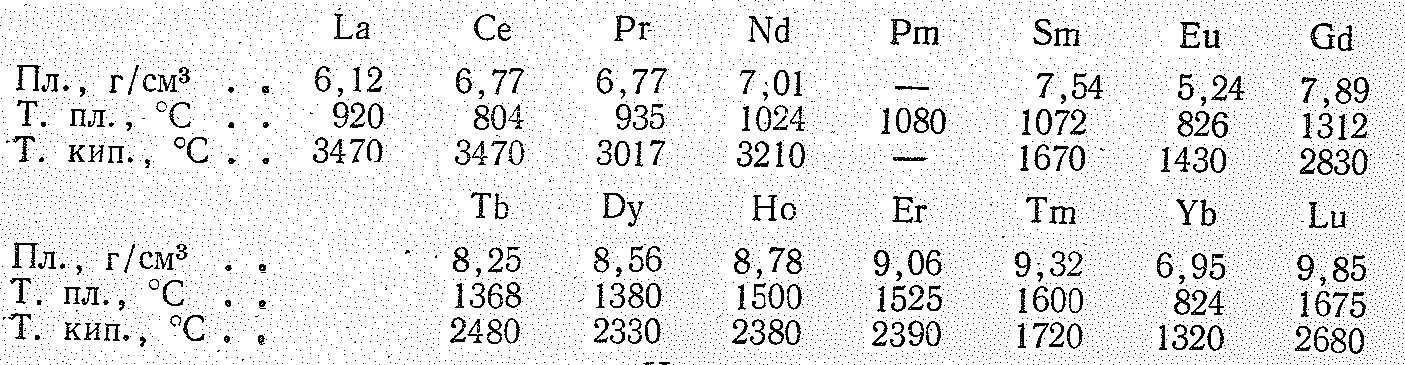
Простые вещества. В виде простых веществ лантаноиды тугоплавкие серебристо-белые металлы (Рr и Nd слегка желтоватого цвета). Некоторые константы их (и для сравнения лантана) приведены ниже:
Как видно из
приведенных данных, от Се к Lu
в изменении плотности, температуры
плавления и кипения проявляется
внутренняя периодичность. Минимальные
значения этих констант приходятся на
Еu
и Yb.
Лантаноиды ковки, имеют относительно невысокую твердость, по элекрической проводимости сходны с ртутью.
По химической активности лантаноиды, как и Lа, уступают лишь щелочным и щелочноземельным металлам. Компактные металлы, правда, довольно устойчивы к сухому воздуху. Во влажном же воздухе они быстро тускнеют. При нагревании (до 200— 400 °С) лантаноиды воспламеняются на воздухе и сгорают с образованием смеси оксидов и нитридов. Церий в порошкообразном состоянии даже пирофорен, т. е. самовоспламеняется на воздухе при обычных условиях. Пирофорность церия и ряда других лантаноидов, используется для получения пирофорных сплавов — «кремней» зажигалок, трассирующих пуль и др.
Лантаноиды взаимодействуют с галогенами, а при нагревании с азотом, серой, углеродом, кремнием, фосфором, водородом. С большинством металлов они дают сплавы. При этом часто образуются интерметаллические соединения.
О б
активности лантаноидов свидетельствуют
также значения их электродных потенциалов:
б
активности лантаноидов свидетельствуют
также значения их электродных потенциалов:
Находясь в ряду напряжений далеко впереди водорода, лантаноиды окисляются водой, особенно горячей, выделяя водород. Тем более активно они взаимодействуют с кислотами. В НF и Н3РО4 лантаноиды устойчивы, так как покрываются защитными пленками нерастворимых солей. В щелочах не растворяются.
Вследствие. большой близости свойств лантаноидов разделение их — одна из труднейших задач химической технологии. В настоящее время разделяют РЗЭ с помощью ионообменных смол и экстракцией соединений органическими растворителями.
Лантаноиды в металлическом состоянии обычно получают восстановлением с помощью кальция хлоридов или фторидов.
Редкоземельные металлы в последнее время приобрели большое значение. Исключительная способность их соединяться со многими - газами используется в вакуумной технике. В металлургии они применяются как легирующие добавки для улучшения механических свойств сплавов. Лантаноиды и их соединения используются в качестве катализаторов в органических и неорганических синтезах, а также в качестве материалов в радио- и электротехнике, в атомной энергетике.

