
Соединения элементов подгруппы меди
Соединения Сu (I), Аg (I), Аu (I). Меди и ее аналогам в степени окисления +1 отвечает электронная конфигурация d10. Полагают, что ионы Э могут выступать не только в качестве -акцепторов, но и -доноров электронных пар. При этом подвижность d-электронных пар в ряду Сu (I)—Аg (I)—Аu (I) возрастает, что определяет усиление в этом ряду способности к -дативному взаимодействию.
Как уже указывалось, степень окисления +1 наиболее характерная степень окисления серебра. У меди и в особенности у золота эта степень окисления проявляется реже. В водных растворах она в основном стабилизируется в присутствии лигандов -акцепторного типа. Так, в растворах равновесия
2Сu+1 (р) Сu0 (т) +Сu+2 (р) и 3Аu+1 (р) 2Аu0 (т) + Аu+3 (р)
смещаются в сторону образования производных Э (I) в присутствии, например, ионов СN- и I-.
Для меди (I) и ее аналогов наиболее характерны координационные числа 2 и 4, а для Аg (I) — также 6.
Так, кристаллы АgСN, АgSСN, АuI, ЭN3 образованы цепочками типа:
|
В кристаллах Сu2O и Аg2О имеет место линейнотетраэдрическая координация атомов, в галогенидах СuНаl координационное число меди равно 4 (структурный тип сфалерита, и галогенидах АgНаl координационное число серебра равно 6 (структурный тип NaCl). |
|
Рис. 1. Кристаллическая структура куприта Cu2O. |
Бинарные соединения Сu (I), Аg (I) и Аu (I) твердые кристаллические солеподобные вещества, в большинстве нерастворимы в воде. Производные Аg (I) образуются при непосредственном взаимодействии простых веществ, а Сu (I) и Аu (I) при восстановлении соответствующих соединений Сu (II) и Аu (III). Из солей кислородсодержащих кислот и Э (I) относительно более устойчивы производные серебра (растворимые в воде АgNО3, АgСlО4, АgСlО3, плохо растворимые Аg2SО4, Аg2СО3 и др.).
Для Э (I) аквокомплексы малостойки и кристаллогидраты не характерны, но для Сu (I) и Аg (I) устойчивы амминокомплексы типа [Э(NН3)2]+. Поэтому большинство соединений Сu (I) и Аg (I) довольно легко растворяется в присутствии аммиака, например:
СuСl (т) + 2Н3N (р) = [Сu(NН3)2] Сl (р)
Аg2О (т) + 4Н3N (р) + Н2O (ж) = 2[Аg(Н3N)2](ОН) (р)
Гидроксиды типа [Э(NН3)2](ОН) значительно устойчивее, чем ЭОH, и по силе приближаются к щелочам. Это объясняется уменьшением поляризующего действия катиона Э+ на ионы ОН- за счет экранирования молекулами аммиака.
Гидроксиды ЭОН неустойчивы. При попытке их получения по обменным реакциям выделяются оксиды Сu2О (красный), Аg2О (темно-коричневый), например:
2АgNО3 (р) + 2NаОН (р) = Аg2О (т) + 2NаNО3 (р) + Н2О (ж)
Кислотная природа бинарных соединений Э (I) проявляется при взаимодействии с соответствующими основными соединениями. При этом образуются различного рода купраты (I), аргентаты (I) и аураты (I). Так, Э2O несколько растворимы в концентрированных растворах щелочей:
Сu2O (т) + 2NаОН (р) + Н2О (ж) = 2Nа[Сu(ОН)2] (р)
Нерастворимые в воде и кислотах галогениды ЭНаl довольно значительно растворяются в крепких растворах галогеноводородных кислот или основных галогенидов:
СuСl (т) + НСl (р) = Н[СuСl2] (р)
АgI (т) + КI (р) = К[АgI2] (р)
Аналогично ведут себя нерастворимые в воде цианиды ЭСN, сульфиды Э2S и пр. Из подобных реакций большое значение имеет реакция растворения галогенидов серебра в растворах тиосульфата натрия
АgВr (т) + 2Nа2S2О3 (р) = Nа3[Аg(S2О3)2] (р) + NаВr (р)
Э та
реакция имеет место при закреплении
фотоматериалов гипосульфитом.
та
реакция имеет место при закреплении
фотоматериалов гипосульфитом.
Из комплексов Э (I) наиболее устойчивы цианидные производные:
Повышение устойчивости в указанном ряду можно объяснить усилением -дативного взаимодействия М—СN.
Т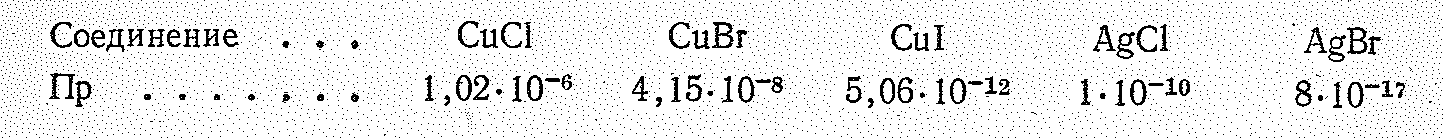 ак
же можно объяснить повышение устойчивости
галогенокомплексов в ряду:
ак
же можно объяснить повышение устойчивости
галогенокомплексов в ряду:
и уменьшение растворимости галогенидов в ряду ЭF—ЭСl—ЭВr—ЭI:
Б ольшинство
соединений меди (I)
и золота (I)
легко окисляется (даже молекулярным
кислородом воздуха), переходя в устойчивые
производные соответственно Сu
(II) и Аu
(III), например:
ольшинство
соединений меди (I)
и золота (I)
легко окисляется (даже молекулярным
кислородом воздуха), переходя в устойчивые
производные соответственно Сu
(II) и Аu
(III), например:
4Сu+1Сl (т) + O2 (г) + 4НСl (р) = 4Сu+2Сl2 (р) + 2Н2O (ж)
Для соединений Сu (I) и Аu (I) характерные также реакции диспропорционирования:
2Сu+1Сl (т) Сu0 (т) + Сu+2Сl2 (р)
3Аu+1Сl (т) + КСl (р) = К[Аu+3Сl4] (р) + 2Аu0 (т)
Большинство соединений Э (I) при небольшом нагревании и при действии света легко распадается. Поэтому их обычно хранят в банках из темного стекла. Светочувствительность галогенидов серебра используется для приготовления светочувствительных эмульсий. Важное значение имеет АgNО3, из которого получают все остальные производные серебра. Оксид меди (I) применяют для окрашивания стекла, эмалей, а также в полупроводниковой технике.
С оединения
Сu
(II).
Степень окисления +2 характерна только
для меди. Максимальное координационное
число Сu
(II) равно 6, что соответствует октаэдрическим
комплексам (структурным единицам)
следующей электронной конфигурации:
оединения
Сu
(II).
Степень окисления +2 характерна только
для меди. Максимальное координационное
число Сu
(II) равно 6, что соответствует октаэдрическим
комплексам (структурным единицам)
следующей электронной конфигурации:
Поскольку на
![]() -орбитали
(в отличие от
-орбитали
(в отличие от
![]() )
имеется только один электрон, связь
Сu-лиганд
за счет
)
имеется только один электрон, связь
Сu-лиганд
за счет
![]() -электронов
прочнее, чем за счет
-электронов
прочнее, чем за счет
![]() -электронов.
Иными словами, четыре лиганда в плоскости
ху
связаны с атомом Сu
прочнее, чем два лиганда, расположенные
по оси z.
Поэтому расстояние между атомами Сu
и лигандами в плоскости ху
короче, чем между атомом Сu
и лигандами, расположенными по оси z,
например в кристалле СuСl2:
-электронов.
Иными словами, четыре лиганда в плоскости
ху
связаны с атомом Сu
прочнее, чем два лиганда, расположенные
по оси z.
Поэтому расстояние между атомами Сu
и лигандами в плоскости ху
короче, чем между атомом Сu
и лигандами, расположенными по оси z,
например в кристалле СuСl2:

Иногда это различие столь велико, что комплексы Сu (II) можно рассматривать как квадратные. Таким образом, чаще всего встречаются соединения, в которых координационное число меди равно четырем (квадрат) и шести (искаженный октаэдр).
Для меди (II) характерны как катионные, так и анионные комплексы. Так, при растворении солей Сu (II) в воде или при взаимодействии СuО (черного цвета) и Сu(ОН)2 (голубого цвета) с кислотами образуются голубые аквокомплексы [Сu(ОН2)6]2+. Такую же окраску имеет большинство кристаллогидратов, например Сu(NO3)26Н2O.
В медном купоросе СuSO45Н2O вокруг Сu (II) координированы четыре молекулы воды в плоскости и две SO42--группы по оси. Пятая молекула Н2O играет роль мостика, объединяющего водородными связями молекулы Н2O в плоскости и SO42—группу (рис. 2):
Р |
Рис. 3. |



 ис.
2.
ис.
2.
