
- •Технологія водопідготовки лабораторний практикум
- •«Хімічна технологія»
- •Передмова
- •Назва лабораторних робіт, їх зміст, об'єм і модулі, до яких вони належать та назви модулів
- •Система критеріїв оцінювання знань з лабораторних робіт
- •Модуль № 1
- •Модуль № 2
- •Яка призначається для питних і виробничих потреб»
- •Модуль № 3
- •Принцип компановки технологічних схем»
- •Модуль № 4
- •Модуль № 5
- •Модуль № 6
- •Модуль № 7
- •Правила оформлення лабораторних робіт
- •Техніка безпеки в хімічній лабораторії
- •Визначення фізичних показників якості води поверхневого джерела
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •Для отримання шкали кольоровості
- •Очікуваного вмісту зависі
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Визначення ступеня мінералізації дніпрової води
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •Прожареного залишку
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Пом’якшення і допом’якшення природної води реагентними методами
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •І допом’якшення води фосфатним методом
- •5 Контрольні запитання
- •6 Література
- •Визначення хлорпоглинаємості і показника, який відображає як хлорується вода
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •Як хлорується вода
- •5 Контрольні запитання
- •6 Література
- •Побудова градуювального графіка
- •1 Метод вимірювання
- •2 Порядок виконання роботи
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Визначення оптимальної дози коагулянту
- •1 Фізико – хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •5 Контрольні запитання
- •6 Література
- •Вивчення впливу вапнування на процес коагуляційної очистки води
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •5 Контрольні запитання
- •6 Література
- •Визначення динамічної обмінної ємності
- •1 Фізико-хімічні основи процесу
- •3 Приготування розчинів
- •4 Порядок виконання роботи
- •До проскакування у фільтрат іонів кальцію
- •5 Методи контролю
- •6 Вимоги до звіту
- •7 Контрольні запитання
- •8 Література
- •Вивчення процесів опріснення і знесолення води
- •1 Фізико-хімічні основи процесу
- •3 Приготування розчинів
- •4 Опис лабораторної установки
- •5 Порядок виконання роботи
- •6 Методи контролю
- •7 Вимоги до звіту
- •Шляхом перегонки
- •8 Контрольні запитання
- •9 Література
- •Список рекомендованої літератури
- •Додаток а Приклад оформлення титульного аркушу лабораторної роботи
- •Додаток б Приклад оформлення титульного аркушу звіту з лабораторних робіт
2 Порядок виконання роботи
2.1 Визначення загальної і карбонатної твердості вихідної природної води
2.2 Визначення об’єму розчину кальцій гідроксиду (вапняного молока)
В конічну широкогорлу колбу ємкістю 250 см3 за допомогою мірного циліндра наливають 200 см3 дослідної проби води з відомою твердістю і піпеткою наливають 50 см3 розчину вапняного молока із вмістом СаО 1 мг/см3, колбу накривають годинниковим склом і ставлять на 10 хвилин у киплячу водяну баню, розташовану на електроплитці (для укрупнення кристалів, що випали). Після цього воду охолоджують до 20oС, фільтрують через фільтр «синя стрічка», який розташовано на скляній лійці, в конічну колбу ємкістю 250 см3.
Першими порціями фільтрату (10 %) обполіскують колбу і виливають їх в каналізацію. Відбирають піпеткою 50 см3 фільтрату в конічну колбу ємкістю 250 см3, додають 2 – 3 краплі фенолфталеїну і титрують 0,05 н розчином хлористоводневої кислоти до знебарвлення розчину.
Об’єм розчину вапняного молока, необхідного для пом’якшення 200 см3 води, визначають за формулою:
![]() =
=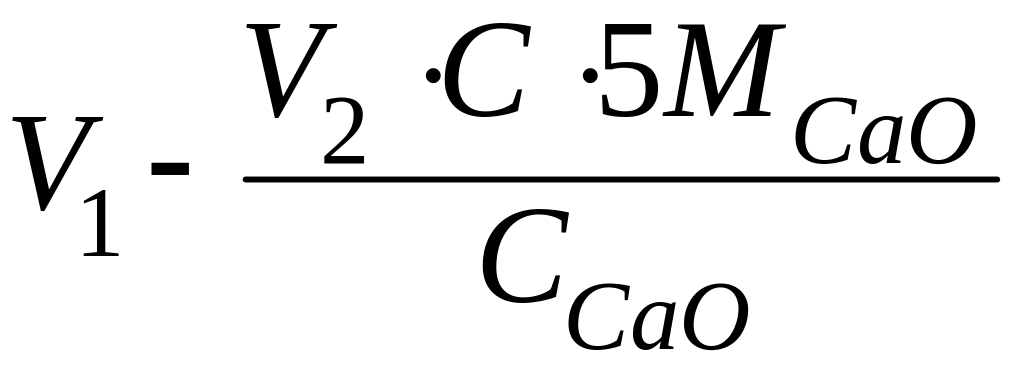 ,см3,
(1)
,см3,
(1)
де V1 – об’єм розчину вапняного молока, який взяли для пом’якшення води, см3;
V2 – об’єм хлористоводневої кислоти витрачений на титрування , см3 ;
С – молярна концентрація еквівалента хлористоводневої кислоти, ммоль/см3;
МСаО – молярна маса еквівалента СаО, мг/моль, М (1/2СаО) = 28,04;
ССаО – концентрація оксиду кальцію у вапняному молоці, мг/см3;
5 – коефіцієнт розбавлення вихідного розчину пробою води.
2.3 Визначення об’єму розчину натрій карбонату
В конічну широкогорлу колбу ємкістю 250 см3 наливають мірним циліндром 200см3 дослідної проби води і вирахуваний у попередньому досліді об’єм розчину вапняного молока , збовтують вміст колби протягом 1 – 2 хвилин. Потім додають у воду 5см3 розчину натрій карбонату(соди) з масовою часткою 5 % і дистильовану воду у кількості (250 – 200 – 5 – VСаО) см3, щоб забезпечити ідентичність умов в обох дослідах. Після повторного збовтування колбу накривають годинниковим склом і ставлять на 10 хвилин у киплячу водяну баню. Після цього воду охолоджують до 20oС і фільтрують у конічну колбу ємкістю 250 см3 через фільтр «синя стрічка».
Першими порціями фільтрату (10 %) обполіскують колбу і виливають їх в каналізацію. В конічну колбу ємкістю 250 см3 вносять піпеткою 100 см3 фільтрату і визначають кількість залишкового натрій карбонату титруванням 0,1 н розчином хлористоводневої кислоти у присутності індикатора метилоранжу.
Об’єм розчину натрій карбонату (соди), необхідного для пом’якшення 200 см3 води, визначають за формулою:
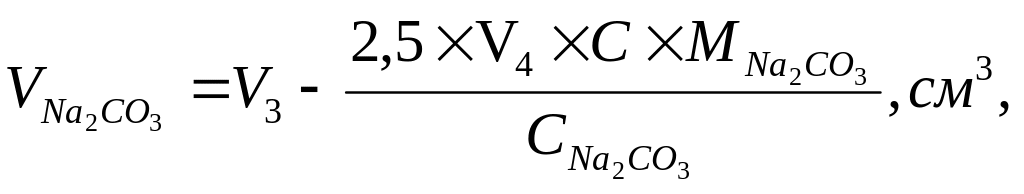 (2)
(2)
де V3 – об’єм розчину натрій карбонату, який взяли для пом’якшення води, см3;
V4 – об’єм хлористоводневої кислоти витрачений на титрування, см3;
2,5 – коефіцієнт розбавлення вихідного розчину пробою води;
С – молярна концентрація еквівалента хлористоводневої кислоти, ммоль/см3;
![]() – молярна
маса еквівалента натрій карбонату,
мг/ммоль, М(1/2
Na2СО3)
= 53;
– молярна
маса еквівалента натрій карбонату,
мг/ммоль, М(1/2
Na2СО3)
= 53;
![]() –
концентрація
розчину натрій карбонату, мг/см3,
знаходиться у довіднику [1, с. 258].
–
концентрація
розчину натрій карбонату, мг/см3,
знаходиться у довіднику [1, с. 258].
2.4 Пом’якшення зразку води
В конічну колбу ємкістю 1 дм3 мірним циліндром наливають 500 см3 дослідної природної води, вводять розраховану кількість розчину вапняного молока, перемішують 1 – 2 хвилини і додають розраховану кількість розчину натрій карбонату. Колбу накривають годинниковим склом і ставлять на 10 хвилин у киплячу водяну баню, розташовану на електроплитці. Після цього воду охолоджують до 20oС, фільтрують через фільтр «синя стрічка» у конічну колбу ємкістю 500 см3. Першими порціями фільтрату (10%) обполіскують колбу і виливають їх в каналізацію.
Для прискорення процесу фільтрування можна проводити на вакуумній установці з воронкою Бюхнера. З фільтрату піпеткою відбирають 100 см3 для визначення залишкової загальної твердості води трилонометричним (комплексонометричним) методом, а 250 см3 фільтрату відбирають мірним циліндром для подальшого пом’якшення води, а саме допом’якшення.
Таким самим чином пом’якшують і другу пробу води.
2.5 Допом’якшення зразку води
В конічну колбу ємкістю 500 см3 мірним циліндром наливають 250 см3 пом’якшеної води, додають розчин натрій фосфату(V), кількість якого еквівалентна залишковій загальній твердості води після пом’якшення.
Для розрахунку кількості розчину натрій фосфату(V), спочатку визначають скільки мг − екв залишкової загальної твердості буде знаходитися у 250 см3 фільтрату після пом’якшення води. Потім визначають кількість розчину натрій фосфату(V) із співвідношення:
1 см3 розчину Na3PO4(Na3PO4*12Н2О) містить 0,1 мг∙екв Na3PO4
х см3 розчину Na3PO4(Na3PO4*12Н2О) містить У мг∙екв залишкової загальної твердості в 250 см3 фільтрату.
Пом’якшену воду з розчином Na3PO4 перемішують. Колбу накривають годинниковим склом, ставлять на 10 хвилин на киплячу водяну баню, потім вміст колби охолоджують до 20oС і фільтрують через фільтр «синя стрічка». Першими порціями фільтрату (10 %) обполіскують колбу і виливають їх в каналізацію. У допом’якшеній воді визначають залишкову загальну твердість води комплексонометричним методом. Для аналізу використовують 100 см3 фільтрату.
