
- •Предисловие
- •Основные меры безопасности при работе в лаборатории
- •Запись эксперитентальных данных
- •Введение
- •Тема 1. Аминокислоты. Белки
- •Лабораторная работа №1 цветные реакции на белки и аминокислоты. Осаждение белков
- •Контрольные вопросы и задания
- •Тема 2. Ферменты
- •Лабораторная работа №2 свойства ферментов
- •Контрольные вопросы
- •Тема 3. Витамины
- •Лабораторная работа №3 качественные реакции на витамины
- •Контрольные вопросы
- •Тема 4. Углеводы
- •Лабораторная работа №4 свойства углеводов
- •Контрольные вопросы
- •Тема 5. Липиды
- •Лабораторная работа №5 свойства жиров
- •Контрольные вопросы
- •Тема 6. Минеральные вещества организма и их обмен
- •Лабораторная работа №6 качественное определение неорганических соединений костной ткани
- •Контрольные вопросы
- •Литература
- •Рекомендуемая литература
- •398020, Г. Липецк, ул. Ленина, 42
Тема 1. Аминокислоты. Белки
В количественном соотношении белки занимают первое место среди всех содержащихся в живой клетке макромолекул. Белки присутствуют во всех клетках, на их долю приходится не менее половины сухого веса клетки. Для построения всех белков, будь то белки бактерий или высших организмов, используется один и тот же набор из 20 различных аминокислот, ковалентно связанных друг с другом в определенной только для данного белка последовательности.
Все 20 аминокислот, встречающихся в белках, характеризуются общей структурной особенностью – наличием карбоксильной и аминогруппы, связанных с одним и тем же атомом углерода.

Различаются же аминокислоты только боковыми цепями (R – группами), которые у разных аминокислот неодинаковы по структуре, электрическому заряду и растворимости в воде.
Все стандартные аминокислоты, кроме глицина, содержат в α-положении асимметрический атом углерода; они обладают оптической активностью, являются L-изомерами.

При попадании в водный раствор аминокислоты ионизируются и ведут себя либо как кислоты
![]() ,
,
либо как основания
![]()
в зависимости от кислотности среды. Вещества с такими двойственными свойствами являются амфотерными. При некотором промежуточном рН может происходить одновременная диссоциация карбоксильной группы и протонизация аминогруппы. В результате образуется биполярный ион:
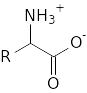
Такие ионы электрически нейтральны, хотя и несут на своих «полюсах» электрические заряды противоположного знака.
Две молекулы одной и той же или разных аминокислот могут ковалентно связываться друг с другом при помощи пептидной связи – СО – NH – с образованием молекулы дипептида.
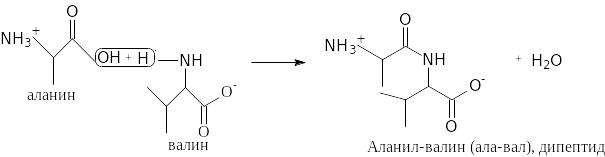
Та же реакция в традиционной форме:

Если таким способом соединить большое количество аминокислот, то образуется полипептид. Полипептиды образуются и при частичном гидролизе длинных полипептидных цепей белков, которые могут содержать сотни аминокислотных звеньев.
Способность аминокислот вступать в химические реакции определяется наличием в их составе функциональных групп. Эти реакции широко применяются для обнаружения, идентификации и количественного определения аминокислот.
Cоединив аминокислоты в различном порядке, можно получить почти бесконечное число последовательностей, и. следовательно, почти бесконечное множество разнообразных белков.
Все белки являются высокомолекулярными полипептидами. Условную границу между крупными полипептидами и белками обычно проводят в области молекулярных масс 8000-10000.
Белки можно классифицировать на основании их биологических функций: ферменты, транспортные белки, сократительные и двигательные, структурные, защитные, регуляторные и др.; по форме их молекул: глобулярные и фибриллярные. При кислотном или щелочном гидролизе белки, как и пептиды, расщепляются с образованием смеси свободных аминокислот, входивших в состав этих белков в качестве строительных блоков.
Многие белки состоят из одних только аминокислот, их называют простыми белками или протеинами. Однако есть белки, которые при гидролизе помимо аминокислот дают и другие химические компоненты. Эти белки называются сложными или протеидами. Неаминокислотная часть сложного белка обычно называется простетической группой. Сложные белки классифицируются в зависимости от химической природы их простетических групп.
Выделяют 4 уровня структурной организации белков.
Под первичной структурой белков понимают аминокислотную последовательность в полипептидной цепи (или цепях) и положение дисульфидных связей, если они имеются.
Вторичная структура белка – это способ укладки полипептидной цепи в упорядоченную структуру, благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями. Вторичная структура представлена в основном такими регулярными структурами как α-спираль и складчатые слои (β-структура).
Третичная структура белка – это общее расположение, взаимная укладка различных областей, доменов (нескольких компактных глобул) и отдельных аминокислотных остатков одиночной полипептидной цепи. Четкой границы между вторичной и третичной структурами провести нельзя, однако под третичной структурой понимают стерические взаимосвязи между аминокислотными остатками, далеко отстоящими друг от друга в цепи.
Четвертичная структура белка – это организация нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. При этом полипептидные цепи связаны между собой нековалентными (не пептидными и не дисульфидными) связями. Такие агрегаты стабилизируются водородными связями и электростатическими взаимодействиями между остатками, находящимися на поверхности полипептидных цепей. Подобные белки называют олигомерами, а составляющие их индивидуальные полипептидные цепи – протомерами, мономерами или субъединицами.
Белки в их естественном состоянии носят названия нативных белков. Денатурация – необратимые изменения, происходящие с белками при нагревании, воздействии кислот, органических растворителей, растворов солей тяжелых металлов и др. Следствием денатурации является потеря белком характерной для него биологической активности. Денатурация не сопровождается разрывом ковалентных связей в полипептидной цепи, т.е. нарушением первичной структуры белка.
